Злокачественная опухоль отличается от других видов опухолей и заболеваний тем, что её клетки схожи со здоровыми клетками организма. Поэтому перед учеными стоит непростая задача: различить клетки и уничтожить только зараженные. На протяжении истории у врачей были разные идеи о том, как это сделать. Сегодня Атлас расскажет о том, как развивалась онкология и чем лечат рак в наши дни.

Иллюстрации: Майкл Ковальски
Гуморальная теория Гиппократа
До 18 века онкологические заболевания было трудно изучать: подходящее оборудование еще не изобрели, церковь запрещала вскрытия, а чума и оспа уносили больше жизней и притягивали к себе внимание. Поэтому с древних времен до нас дошло мало записей о злокачественных опухолях, но все же они есть.

Первые упоминания рака встречаются в папирусе Эдвина Смита — медицинском тексте Древнего Египта, который датируется 16 веком до нашей эры. Этот папирус можно полистать и почитать. Случай № 45 как раз описывает злокачественные опухоли. Там же отмечается, что метода лечения нет.
Гиппократ (400 лет до нашей эры) первым начал различать доброкачественные и злокачественные опухоли. Он считал, что тело человека содержит четыре гумора, или жидкости — кровь, слизь, желтую и черную желчь, — а любой дисбаланс приводит к заболеваниям. Считалось, что причина злокачественных опухолей — скопление черной желчи в определенном месте. Гиппократ отмечал, что без лечения больные могут прожить дольше: черная желчь уже распространилась по организму и удалить ее нельзя.
Конечно, никакой черной желчи в организме человека нет, но идея о распространении опухоли по организму оказалась верной. Злокачественные клетки со временем отделяются от опухоли и дают метастазы.
Врачи и знахари пользовались гуморальной теорией более 1300 лет. В течение этого периода вскрытия были запрещены по религиозным соображениям, что ограничивало изучение опухолей. Доступными методами лечения в древние времена и Средневековье были хирургия, прижигание, кровопускание и обряды.
Первые хирургические вмешательства
Хирургия — одна из самых древних отраслей медицины. Однако в средневековые времена вмешательства не всегда приводили к нужным результатам из-за большой потери крови, высокого риска заражения после операции, отсутствия антисептиков.
Гален
Римский врач Гален (130-200 годы нашей эры) писал о хирургическом лечении рака молочной железы на ранней стадии, но не считал этот метод эффективным для лечения крупных и «скрытых» опухолей. Он придерживался гуморальной теории и предполагал, что черную желчь удалить из организма полностью нельзя. Такой подход спас жизнь многим людям: в Средневековье пациенты часто умирали во время операции или из-за осложнений после нее.
Отмена гуморальной теории
После отмены запрета на вскрытия в 16 веке Андреас Везалий составил первый анатомический справочник тела человека, а веком позже Метью Бейли описал строение различных патологий. Гуморальную теорию пришлось пересмотреть, так как никакой черной желчи ученые не нашли.

В 17 веке начали развиваться хирургические методы удаления опухолей. Немецкий хирург Вильгельм Фабри во время операции по удалению рака молочной железы вырезал опухоль вместе с увеличенными лимфоузлами, а голландский хирург Адриан Гельвеций проводил мастэктомию, полное удаление молочной железы. Несколько лет спустя, он писал про один из случаев: «С тех пор пациентка полностью выздоровела. Боли совершенно прекратились, рубцы зажили, и она наслаждается тем же состоянием здоровья, которое у нее было до рака».
В 1850–х немецкий ученый Рудольф Вирхов обнаружил в опухолях бесконтрольное деление клеток. Он назвал это явление неоплазией, а его главный труд «Клеточная патология» стал основой для понимания причин развития онкологических заболеваний.
Обезболивание и антисептик
В 1846 году был изобретен наркоз. Это решило проблему с болью, так как до этого людям приходилось переживать операцию в сознании. А в 1867 году французский врач Джозеф Листер открыл, что мазь на основе карболовой кислоты действует как антисептик и способствует заживлению раны после операции.
Анестезия и первый антисептик расширили возможности хирургии, и операции стали проводиться повсеместно. Однако в некоторых случаях опухоли появлялись вновь. Тогда хирурги начали расширять объемы вмешательств, что в итоге привело к возникновению метода радикальной хирургии.
Радикальная хирургия
Хирург Уильям Холстед думал, что чем больше тканей удалить во время операции, тем меньше будет вероятность рецидивов. Вывод не совсем верный, так как злокачественные клетки еще до операции могли распространиться по организму и метастазировать в другие ткани.

Только в 1970–х годах в ходе клинических испытаний было доказано, что менее обширные операции эффективны так же, как и радикальные. К сожалению, к этому времени радикальная мастэктомия набрала большую популярность и считалась практически единственным верным методом лечения рака молочной железы.
Современность
В 1990-е годы хирурги минимизировали вмешательства в здоровые ткани человека. Сегодня операции делятся на два вида: открытые и малоинвазивные. Для открытой операции врач делает большой разрез, чтобы удалить опухоль, нездоровые ткани и, возможно, лимфоузлы.
Для проведения малоинвазивной операции врач делает несколько небольших разрезов, находит опухоль с помощью тонкой трубки с камерой (лапароскопа) и через другой разрез удаляет опухоль инструментами. После этой операции пациент восстанавливается быстрее.
Лучевая терапия
В конце 19 века ученых обратили внимание на способность рентгеновских лучей убивать злокачественные клетки. Тогда никто еще не догадывался, насколько губительно излучение действует и на здоровые ткани.
Рентгеновские трубки
Рентгеновские лучи были открыты в 1895 году, одновременно с развитием радикальной хирургии. Через год после этого молодой врач Эмиль Груббе заметил, как разрушаются кожа и ногти у людей, которые работали с источниками излучения. Он предположил, что лучи убивают и клетки опухоли, и был первым, кто использовал лучевую терапию для лечения онкологии.
Метод быстро набрал популярность: в Европе и США открывались новые клиники, предлагающие лучевую терапию. Она была эффективной в тех случаях, когда опухоль не успела распространиться на другие органы.
Идея использовать излучение была отличной, но она не учитывала два существенных минуса рентгеновской трубки: неоднородный поток излучения и недостаточную проникающую способность. Большая часть дозы поглощается другими тканями или рассеивается. Таким образом рентгеновские лучи увеличивают количество мутаций в здоровых клетках, что приводит к формированию новых опухолей. Такой вариант нельзя считать подходящим лечением.
Радий
В 1902 году ученые Пьер и Мария Кюри открыли радиоактивные свойства радия. На первый взгляд, это вещество проникало глубже рентгеновских лучей и давало больше возможностей для лечения. На протяжении 10 лет после открытия радия у многих врачей и ученых, не знающих об опасности облучения, развивались различные злокачественные заболевания. Так продолжалось до тех пор, пока не появились первые дозиметры и стандарты измерений радиоактивного излучения.
Ускоритель электронов и радиоактивный кобальт
В 1940 Дональд Керст собрал бетатрон — циклический ускоритель электронов. Устройство испускает частицы, обладающие высокой энергией и проникающей способностью, поэтому при его использовании возникает мало рассеянных лучей. В 1951 шведский нейрохирург Ларс Лекселл разработал аппарат «Гамма-нож». Он имеет несколько источников излучения радиоактивного кобальта и дает однородный пучок большой энергии. Бетатрон и гамма-нож успешно применяются для лечения опухолей и сегодня.
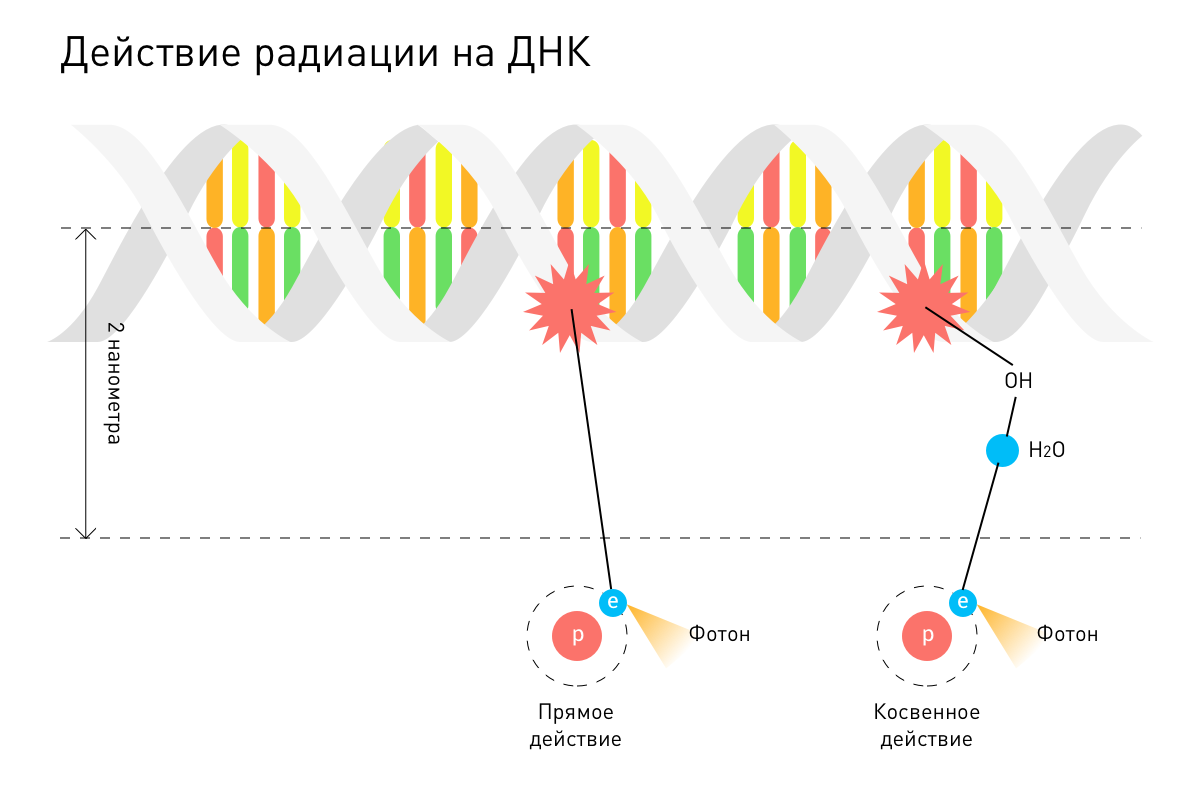
Излучение разрушает ДНК клеток прямо или косвенно. Во втором случае вода, которая содержится в клетках, превращается в свободные радикалы — заряженные частицы, повреждающие ДНК. Излучение не разбирает, какие клетки разрушать, здоровые или злокачественные, поэтому аппараты требуют внимательной настройки, чтобы пик дозы приходился на нужную глубину.
Современность
Сегодня в онкологии используют рентгеновское излучение, гамма-лучи и заряженные частицы. Они могут поступать в тело и воздействовать на злокачественные клетки через специальное устройство либо исходить от радиоактивного материала, помещенного в тело пациента рядом с опухолью (брахитерапия).
Существует также третий вид лучевой терапии — системный. Пациенту вводят радиоактивную жидкость, например йод, который находит и убивает клетки опухоли. Но в этом случае трудно учесть точное количество изотопа, которое поглощает организм, и доза может нанести вред.
Химиотерапия
Хирургия и лучевая терапия применялись для лечения солидных опухолей, которые развиваются не из клеток кроветворной системы. Как лечить лимфомы и лейкемию никто не знал.
Горчичный газ
Идея использовать токсичные вещества для лечения этих заболеваний возникла после Первой мировой войны. В это время в качестве химического оружия применялся иприт — горчичный газ. Он обжигал кожу и слизистые оболочки, а также убивал лейкоциты: у раненых они практически отсутствовали.
Ученые задались вопросом, может ли иприт вылечить лимфому — опухоль лимфатической ткани. При этом заболевании лимфоциты бесконтрольно делятся и нарушают работу лимфатических узлов и других органов, поэтому сокращение лимфоцитов казалось верным решением. В 1942 году после исследований на животных больному лимфомой ввели внутривенно 10 доз иприта. Количество лимфоцитов быстро упало, а опухоль уменьшилась, но позже начала расти вновь. Это означало, что терапия подействовала, но дозы было недостаточно для полного выздоровления.
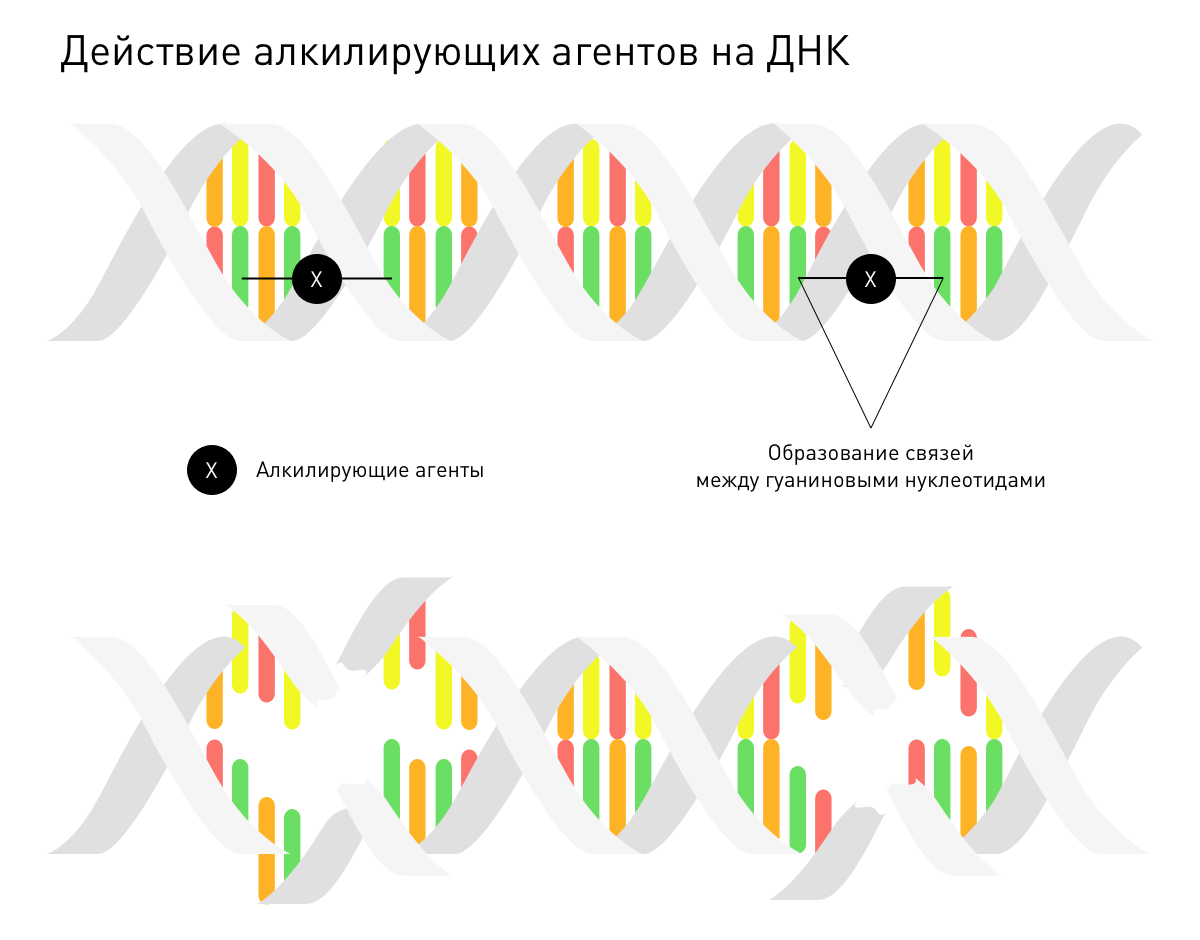
Ремиссия наступала потому, что горчичный газ входит в группу алкилирующих агентов, которые разрушают ДНК клеток и не дают им делиться. Но тогда об этом еще ничего не знали.
Предшественник метотрексата
В 1947 году врач Сидни Фарбер показал, что производное фолиевой кислоты, аметоптерин, подавляет у детей развитие острого лейкоза, который характеризуется бесконтрольным делением белых клеток крови. Этот препарат был предшественником метотрексата, который применяют и сейчас.
Результаты биопсии костного пациентов после курса лечения аметоптерина были в норме. Химиотерапия продлевала жизнь детей до 6 месяцев, но затем болезнь возвращалась. Фарбер бросил все силы на то, чтобы найти лекарство, которое смогло бы вылечить лейкемию полностью. Тогда трудно было предположить, что нужно использовать сразу несколько токсичных веществ, а не одно.
В 1950 году Гертруда Элион разработала препарат 6-меркаптопурин (6-МП), который быстро получил разрешение к применению у детей с лейкозом. После него врачи снова наблюдали недолгую ремиссию.
Комбинированная химиотерапия
Позже были проведены рандомизированные клинические испытания, в ходе которых стало ясно, что использование двух препаратов вместо одного продлевает ремиссию и улучшает прогноз.
В 1956 году доктор Мин Чиу Ли клинически подтвердил, что комбинация из четырех препаратов вылечила метастатическую хориокарциному у беременных. Национальный институт онкологии сначала расценил эти действия как агрессивное и лишнее лечение пациентов, и ученого отстранили от работы. Только потом стало понятно, что выжили только те женщины, которые прошли полный курс лечения Ли. Это был первый случай полного излечения методом химиотерапии.
Адъювантная химиотерапия
В 60 и 70–е годы ученые пробовали использовать химиотерапию как дополнительный метод лечения рака молочной железы после операции. Хирурги неохотно шли на клинические исследования: никто не хотел иметь дело с дополнительными побочными эффектами у пациентов. Но они были неправы.
На деле, любая опухоль — системное заболевание. Злокачественные клетки распространяются по организму даже на ранних стадиях в виде микрометастазов. Они остаются в организме даже после удаления опухоли, поэтому локальных методов лечения недостаточно. Нужно системно воздействовать на заболевание с помощью лекарственного лечения. Например, адъювантная терапия (курс химиотерапии после операции) позволяет снизить риск рецидива и смерти.
Несколько исследований доказали положительный результат адъювантной химиотерапии для лечения рака молочной железы и колоректального рака. Также в 1974 году был доказан положительный эффект в случае метастатического рака яичек, и химиотерапию стали применять для лечения солидных опухолей.
Препараты для химиотерапии останавливают и замедляет деление клеток. Во время курса лечения гибнут те клетки, которые быстро делятся. Это не только злокачественные клетки, но и здоровые, что приводит к побочным эффектам: выпадению волос, тошноте, подверженности инфекциям.
Иммунотерапия
Иммунотерапия — относительно новый вид лечения рака. В его основе лежит использование препаратов, тренирующих клетки иммунитета пациента. Это стало возможным благодаря открытию структуры ДНК, изучению особенностей злокачественных клеток и клеток иммунной системы.
Вакцина Коли
В 1891 году Вильям Коли заметил, что у онкобольных, перенесших скарлатину или рожистую болезнь, наступала ремиссия. После этого он начал вводить пациентам с последней стадией рака бактерии стрептококков. Опухоль уменьшалась, но больные умирали от инфекции. Тогда Коли нагревал вакцину и вводил пациентам мертвые стрептококки.
Результат для того времени был впечатляющим: больные выздоравливали и жили несколько лет. Однако вакцина Коли не получила широкого распространения. Ученые не могли объяснить механизм, как бактерии действуют на опухоль, а риск инфицирования был высоким. Всех гораздо больше интересовала химио- и лучевая терапия.
В 1976 году для лечения рака мочевого пузыря успешно применили вакцину BCG, которая использовалась для предупреждения туберкулеза. Она активизирует иммунную систему и помогает организму бороться с этим видом рака.
Моноклональные антитела
В 1975 году Жорж Кёллер и Сезар Мильштейн опубликовали статью о методе получения клеточного гибрида опухолевой клетки и лимфоцита. Гибридомная технология позволяет обнаружить антигены, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей. Такие антитела называются моноклональными: они вырабатываются иммунными клетками-клонами, которые происходят из одной родительской клетки.
Другие типы антител маркируют раковые клетки, чтобы иммунной системе было легче найти и уничтожить их.
В конце 1990 годов FDA одобрила первые терапевтические моноклональные антитела, ритуксимаб и трастузумаб. Первый для лечения лимфомы, а второй — рака молочной железы.
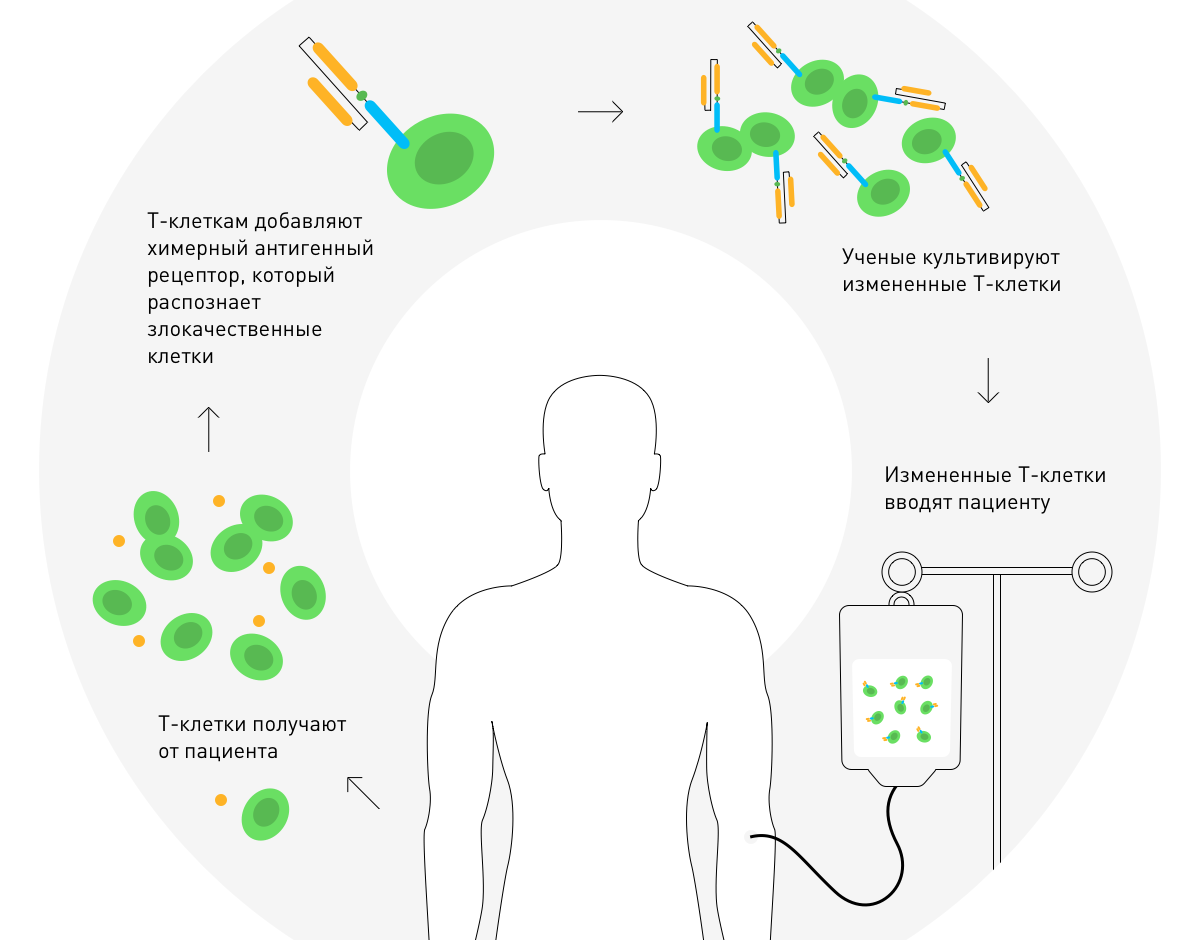
В 2010 году Стивен Розенберг объявил об успехе терапии химерными антигенными рецепторами. В основе нее лежит генетическая модификация Т-клеток пациента для лечения злокачественной опухоли.
Цитокины
Другой метод иммунотерапии — введение в мышцу или вену цитокинов, биологически активных белков, которые регулируют иммунную реакцию. Интерлейкин-2 помогает клеткам иммунной системы быстрее делиться, а интерферон — бороться с вирусными инфекциями и злокачественными опухолями.
Контрольные точки
Еще одно перспективное направление — воздействие на иммунные контрольные точки, которые подавляют ответ иммунной системы. Ученые научились блокировать контрольные точки на Т-клетках, что помогает иммунной системе распознавать и атаковать злокачественные клетки. Этот метод уже одобрен FDA для лечения онкологических заболеваний.
Подобрать оптимальное лечение можно с помощью молекулярной диагностики. Ученые исследуют операционный материал или биопсию пациента, чтобы выявить мутации в протоонкогенах и генах супрессорах. Набор мутаций индивидуален для каждой опухоли, поэтому лечение должно быть персонализированным. В следующий раз Атлас подробно расскажет о молекулярной диагностике.
Автор: Анастасия Попова






