Не так давно я подарил одному своему родственнику, видному системному администратору, книгу Александра Панчина «Сумма биотехнологии» ввиду имеющегося интереса родственника к теме. Спустя пару недель после свершения акта дарения я поинтересовался, быть может, возникли какие-нибудь вопросы? Вопросы возникли, в частности, было решительно непонятно что такое «кодон». У меня было свободное время, да и тема не казалась мне сложной, нужно было просто пробежаться по школьной биологии. Я сделал добротную презентацию (объяснялась центральная парадигма молекулярной биологии ДНК-РНК-Белок), отправил её по почте и после этого по скайпу в течение часа пояснял что там написано. На следующий день я поинтересовался, что же мой родственник запомнил и услышал следующее: ДНК превращается в РНК (именно что превращается одно в другое), РНК превращается в белок, белок состоит из аминокислот, а аминокислоты состоят из хромосом.
В общем тут я и решил написать цикл статей о молекулярной биологии на те темы, которые уже были многократно освещены на хабре/гиках, но при этом авторы не вдавались в конкретику. А начать я решил с β-лактамных антибиотиков, механизма их действия и причин резистентности. А если это будет кому-то интересно, то в будущем расскажу про другие антибиотики, генную инженерию, современные методы в медицине и прочее-прочее-прочее.
Механизм действия β-лактамных антибиотиков
Итак, приступим.
Для того, чтобы понять как работают антибиотики нужно прежде всего знать как устроены те, с кем они борются, то есть архитектуру бактериальной клетки.
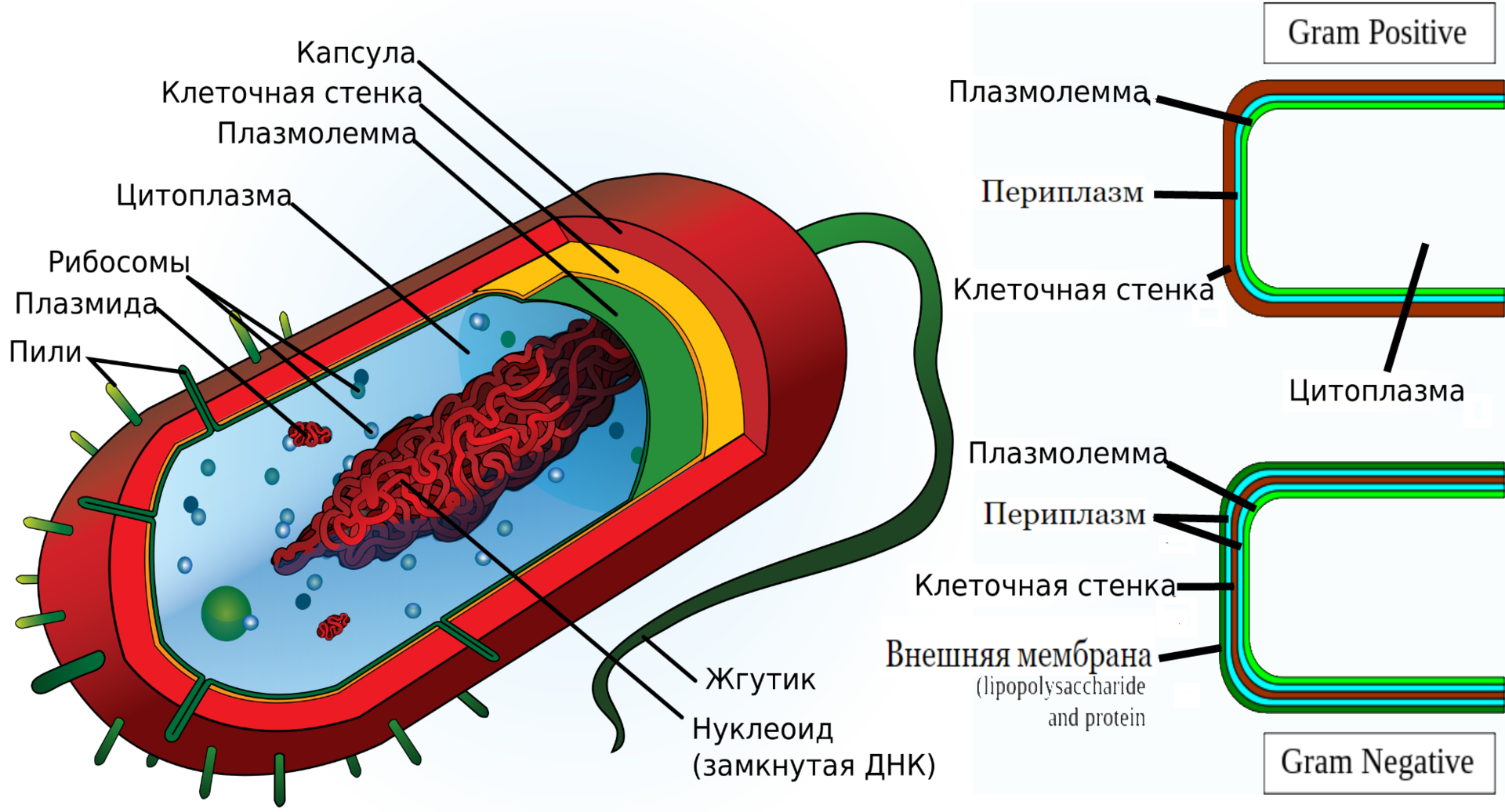
Слева — Грамположительная бактерия. Справа показана разница между Грам+ и Грам- бактериями.
Начнём рассматривать бактериальную клетку с внешней стороны. Капсула строго говоря не является частью бактериальной клетки и зачастую вообще не приводится на схемах, она представляет собой слизистую структуру, которая предохраняет бактерии от повреждений, высыхания, а также препятствует фагоцитозу бактерий. При этом капсула легко отделяется от бактериальной клетки.
Идём дальше. Первое, без чего бактерия уже ну никак не проживёт — это клеточная стенка. Она представляет собой жёсткую оболочку, выполняющую структурные, защитные и транспортные функции. Она бывает двух типов: грам+ и грам-. Оба типа имеют в своём составе пептидогликан (муреин), но при этом грам- бактерии имеют относительно тонкий слой пептидогликана, покрытый с внешней стороны дополнительной внешней мембраной, в то время как грам+ бактерии не имеют внешней мембраны, зато их пептидогликановый слой заметно толще. Под пептидогликановым слоем и у грам+, и у грам- бактерий находится плазматическая мембрана, или «плазмолемма».
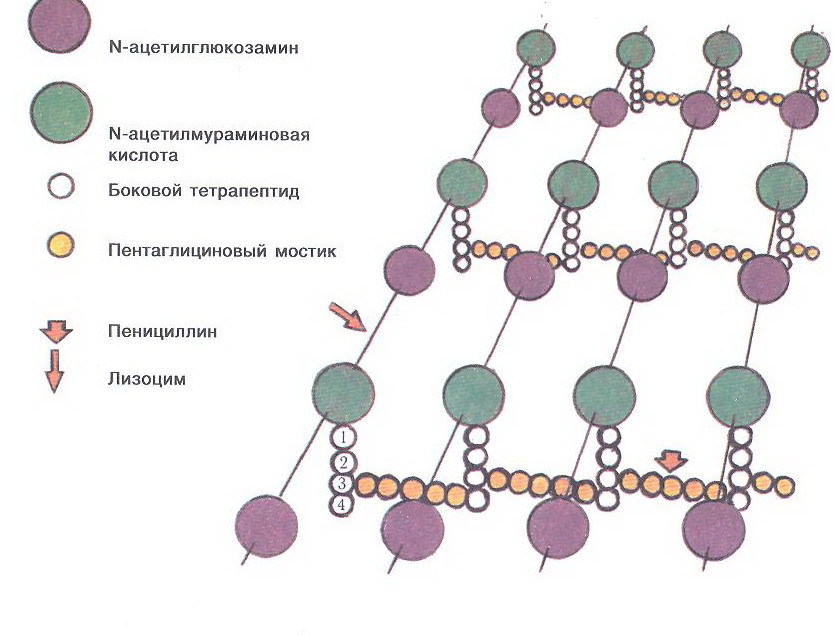
Пептидогликановый слой — гетерополимеры N-ацетилглюкозамина (или просто НАГ) и N-ацетилмурамовой кислоты (НАМ) (на рисунке один гетерополимер — это «бусины на ниточке»), соединённые между собой через боковые тетрапептиды и пентаглициновые мостики. Исторически процесс синтеза пептидогликана является первой мишенью, которую атаковали самые ранние антибиотики — пенициллины, открытые Александром Флемингом в 1928 году и нашедшие широкое применение в медицине в 1942 году.
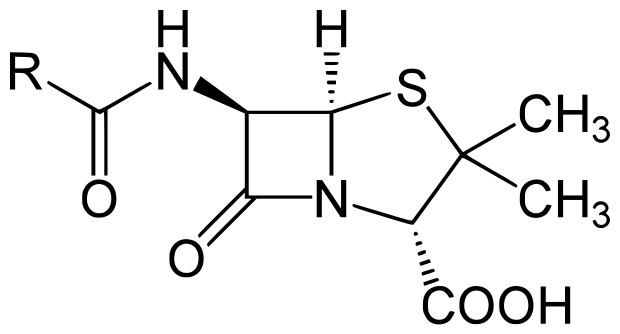
Структура ядра пенициллинов. R — вариабельная группа, природа которой влияет на комплекс характеристик препарата.
Перед рассмотрением механизмов бактериальной токсичности антибиотиков — пара слов о том, что такое фермент. Фермент — это белковая молекула, катализирующая некоторую реакцию, причём некоторые ферменты мультизадачны и выполняют сразу несколько функций. Ферментативный катализ — это чрезвычайно мощная вещь: ускорение реакции может достигать 10^10 раз. То есть смело можно сказать, что без фермента реакция не протекает вовсе.
Копирование ДНК (репликация ДНК-зависимой ДНК-полимеразой), синтез РНК (транскрипция ДНК-зависимой РНК-полимеразой), синтез белков (трансляция рибосомой), метаболизм всего и вся, в общем этот список можно было бы продолжать бесконечно — всё это катализируют (читай — обеспечивают) ферменты. Важно ещё и то, что ферменты — высокоспецифичные катализаторы, которые ускоряют реакции только в том случае, если субстрат идеально подходит под геометрию активного центра (АЦ) фермента («ключ-замок»). У фермента в простейшем случае можно найти некие участки, которые вовлечены непосредственно в его функционирование (АЦ, в которых непосредственно и происходит химическое превращение) или регуляцию активности. Как же можно подавить действие фермента?
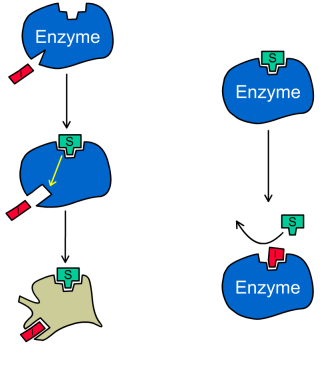
Если рассматривать этот вопрос несколько упрощённо, то существует два основных типа ингибирования: неконкурентное (на рисунке оно слева) и конкурентное (справа). При неконкурентном ингибировании ингибитор (красный блок с буквой «I») связывается с неким сайтом, отличным от активного центра. При этом белок (в том числе и АЦ) немного перестраивается, что приводит к тому, что он теряет способность связываться с субстратом (зелёный блок Т из тетриса) или ускорять нужный химический процесс. Напротив, при конкурентном ингибировании ингибитор связывается непосредственно с АЦ. Конкурентные ингибиторы отличаются высоким сходством пространственной структуры с субстратом, что и приводит к тому, что они могут взаимодействовать с АЦ фермента. При этом вовсе необязательно фермент будет каким-то образом химически изменять ингибитор, он может просто сидеть мёртвым грузом в активном центре и не давать туда залезть субстрату. С другой стороны, архитектура ингибитора может быть такова, что он всё таки взаимодействует с АЦ, но при этом происходит ковалентное присоединение получившегося производного к активным группам АЦ, АЦ перестаёт функционировать и фермент «ломается». Такое ингибирование называется необратимым.
Каков механизм действия пенициллинов и других β-лактамных антибиотиков? Как было указано выше, пептидогликан состоит из цепочек (-НАГ-НАМ-)n, соединённых между собой через боковые тетрапептиды и пентаглициновые мостики. Данные мостики ковалентно связывают два гетерополимера. Они это, конечно, не делают сами по себе потому что им так хочется. Реакцию соединения гетерополимеров через мостики катализируют особые ферменты, которые были названы «пенициллиносвязывающие белки» (далее PBP, от Penicillin binding proteins). Установлено, что β-лактамные антибиотики связываются с АЦ PBP, претерпевают каталичитеское изменение и ковалентно пришиваются к аминокислотному остатку серина в АЦ. После этого фермент полностью отключён.
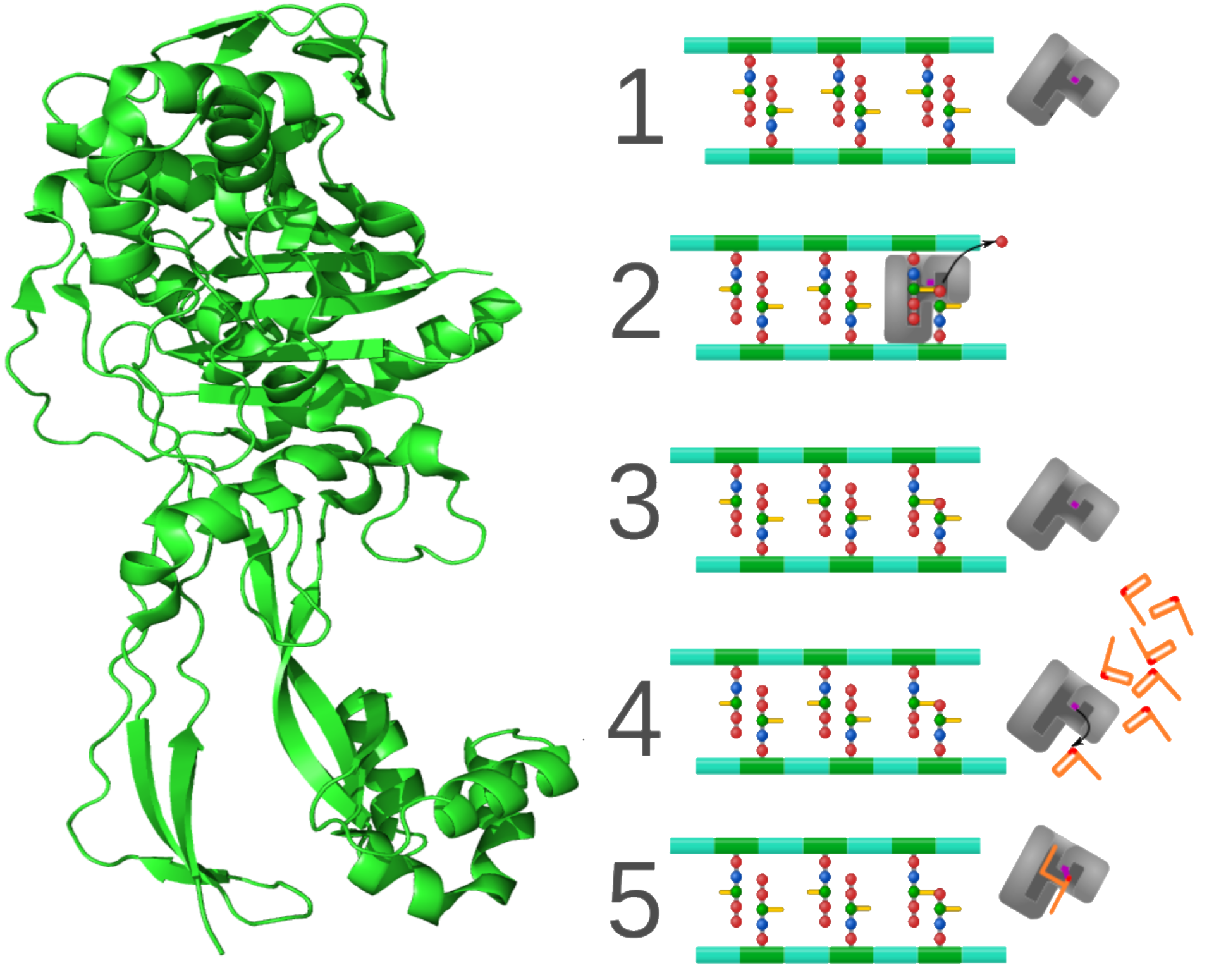
Слева — PBP. Справа показана схема действия PBP (большая серая буква Г с яркой точкой — АЦ) и β-лактамных антибиотиков (оранжевые буквы Р). В норме PBP соединяет гетерополимеры (зелёно-голубые линии (-НАГ-НАМ-)n), а в присутствии антибиотика он необратимо ингибируется.
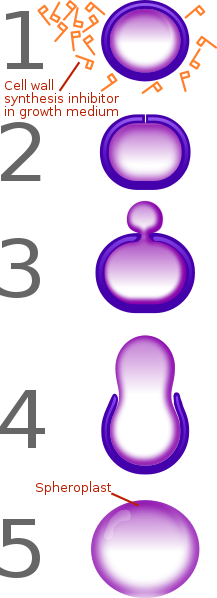
Чем отключение PBP чревато для бактериальной клетки? Прежде всего тем, что она теряет способность создавать новую клеточную стенку, а данный процесс является необходимым во время деления. В результате это приводит к тому, что клетка лишается клеточной стенки (образуется сферопласт), а в таком виде она способна выживать только в специально созданных для этого изотонических растворах.
Таков в общих чертах механизм действия β-лактамных антибиотиков.
Резистентность к β-лактамным антибиотикам
Справедливости ради стоит отметить, что резистентность бактерий к антибиотикам не является чем-то неожиданным. Ещё Флеминг отмечал, что нельзя использовать пенициллин в течение короткого времени и в совсем малых количествах, поскольку при этих условиях у бактерий развивается устойчивость. Как она организована в случае β-лактамных антибиотиков?
Весьма распространённой причиной устойчивости является наличие в клетке фермента β-лактамазы (ген blaZ), который гидролизует β-лактамное кольцо в молекуле антибиотика, тем самым деактивируя его. Для борьбы с этой проблемой был предпринят ряд мер: были разработаны специальные ингибиторы β-лактамаз. Так, совместный приём клавулановой кислоты (необратимое ингибирование β-лактамазы), сульбактама или тазобактама с антибиотиками ампициллином, амоксициллином, тикарциллином или пиперациллином даёт очень хорошие результаты.
Другая причина устойчивости бактерий — мутантный пенициллиносвязывающий белок PBP2a, кодируемый геном mecA. АЦ данного фермента изменён мутацией таким образом, что β-лактамные антибиотики не в состоянии с ним соединиться. При этом регуляция активности mecA устроена весьма умно: РНК транскрибируется с гена mecA только тогда, когда в клетке обнаруживается β-лактамный антибиотик. Хитро придумано, не так ли? Методы по обходу данного механизма защиты пока не разработаны.
Одной из наиболее опасных устойчивых к β-лактамным антибиотикам бактерий является метициллин-резистентный золотистый стафилококк (МРЗС) Staphylococcus aureus, в группе риска которого находятся больничные пациенты, больные сахарным диабетом, люди с ослабленной иммунной системой (люди с ВИЧ-инфекцией/СПИД, больные раком, пациенты после пересадки органов, тяжёлые астматики и т. д.), спортсмены (раздевалки, спортзалы), дети, проживающие в общежитиях студенты, расквартированные в казармах военные, заключённые и бездомные в приютах. По данным 2005-2007 годов в США примерно 4,6% пациентов медицинских учреждений всех типов были инфицированы или колонизированы клетками МРЗС. Сегодня при терапии носителей МРЗС используется антибиотик из группы трициклических гликопептидов Ванкомицин. В случае, если наблюдается резистентность к ванкомицину (т.н. ванкомицин-резистентный золотистый стафилококк) используют Клиндамицин (полусинтетический антибиотик группы линкозамидов), Линезолид (принадлежит к классу оксазолидинонов) или Даптомицин (антибиотик из группы циклических липопептидов). Если к теме будет проявлен интерес сообщества, то я как-нибудь про них расскажу.
Стоит отметить, что МРЗС продолжает развиваться. Недавно у разводимых домашних животных был зарегистрирован штамм МРЗС, названный СС398, который не является патогенным для животных, но опасен для человека. В целом же ситуацию с последствиями применения антибиотиков в сельском хозяйстве хорошо характеризуют данные, полученные в 2011 году в США: 24,4% всего поставляемого на рынок мяса является носителем штаммов, устойчивых как минимум к трём типам антибиотиков. Эти штаммы пока непатогенны.
Кроме вышеобозначенных способов защиты бактерий от посягательств медперсонала можно выделить универсальные механизмы, неспецифичные к конкретному антибиотику. Но об этом как-нибудь в другой раз.
Всем спасибо и не болеть!
Использованные материалы:
ru.wikipedia.org/wiki/Бактерии
ru.convdocs.org/docs/index-207026.html
en.wikipedia.org/wiki/Methicillin-resistant_Staphylococcus_aureus
www.sciencedaily.com/releases/2011/04/110415083153.htm
Также использовались ссылки, приведённые в данных источниках.
Автор: Испанский лётчик

