16+
Еще в самом первом моем посте на Хабре я вскользь затронул один маркер цивилизации XX века, а конкретнее – его медицины, который на самом деле поражает меня сильнее космонавтики и даже сильнее Интернета.
Я упоминал о серповидноклеточной анемии. Это генетическое заболевание, приводящее к деформации эритроцитов, мешает развитию малярии, поэтому в Африке повышало шансы индивида на выживание – как меньшее зло.
XX век – его конец и начало XXI века – отметились стратегической победой над инфекционными болезнями и переходом к борьбе против генетических, к которым по ряду показателей примыкает рак. Хина и карболка Миклухо-Маклая уступили место чудесам фармакологического искусства, названия которых оканчиваются на –маб и –вир.
Генетические заболевания принципиально отличаются от инфекционных как по принципу передачи (вертикально, а не горизонтально), так и гораздо меньшей распространенностью в глобальной популяции с резкими всплесками локально – как в случае с болезнью Хантингтона на озере Маракайбо (глава 12).
Тем не менее, организованная борьба с генетическими заболеваниями уже началась. Поскольку она требует не просто «знать врага в лицо», но и «разбирать врага до косточек», эта борьба дает богатый урожай знаний о природе человека, его фичах и багах. И даже на фоне генетических заболеваний особняком стоит «баг» невообразимо чудовищный, редчайший и при этом крайне информативный. Это синдром Вернера, а также синдром Гетчинсона-Гилфорда, более известные как «детская» и «взрослая» прогерия.
Прогерия — это генетический дефект, приводящий к стремительному физическому одряхлению. Впервые прогерия была выявлена в 1886 году Джонатаном Гетчинсоном, который описал истончение кожных покровов и исчезновение подкожной клетчатки у шестилетнего мальчика. С тех пор в мире зафиксировано более 300 случаев прогерии.
Из-за крайней редкости прогерии (примерно 1 случай на 8 миллионов детей) и ее глубокой генетической подоплеки до сих пор невозможно уверенно судить о механизмах ее наследования. Взрослая прогерия (синдром Вернера) связана с дефектом гена WRN, детская прогерия – с дефектом гена LMNA. Оба этих гена в исправном состоянии отвечают за репарацию клеток и гомеостаз стволовых клеток.
Хотя прогерия и является врожденной, признаки ее проявляются примерно на 2-3 году жизни. Болезнь начинается с характерных пигментных пятен или сыпи на теле. Затем у ребенка истончается кожа, через нее начинают просвечивать вены. Ребенок перестает набирать вес, у него происходят все более быстрые старческие изменения, в первую очередь затрагивающие кожные покровы: выпадают волосы, кожа сморщивается и обвисает. Также наступают прочие старческие изменения, связанные с одряхлением: атеросклероз, нарушение функции почек, артрит.
При этом прогерия нисколько не усугубляет интеллектуального развития ребенка; напротив, дети с прогерией быстро и хорошо учатся, а также зрело осознают не только свое состояние, но и восприятие этой болезни со стороны окружающих и близких.
Люди и лица
Возможно, прогерия наследуется по аутосомно-рецессивному типу по мужской линии. Среди изученных случаев детской прогерии отмечается сравнительно немолодой возраст отцов: около 37 лет. Все известные случаи детской прогерии относятся к представителям белой расы, кроме черной Онталаметсе Фалатсе из Йоханнесбурга, которая умерла в 2017 году в возрасте 18 лет.

Абсолютное большинство детей с прогерией не доживают до совершеннолетия. Известны единичные случаи преодоления двадцатилетнего возраста. В таком возрасте некоторые больные уже даже успевают реализоваться и жить полной жизнью, насколько это возможно. Так, одним из самых возрастных людей с прогерией был Леон Бота (1985 - 2011) из Кейптауна. Он стал диджеем и прославился под псевдонимом DJ Solarize; также Леон Бота был талантливым живописцем:

В 2010 году Леон Бота пережил инсульт и прожил еще около года, умерев на следующий день после своего 21-летия.
Среди известных больных с прогерией рекорд долгожительства принадлежит Тиффани Ведекинд (род. 1978) из города Колумбус, штат Огайо, которая дожила до настоящего времени (сейчас ей 43):

Прогерией также болел ее старший брат Чед, умерший в 2012 году в возрасте 39 лет вскоре после того, как ему был диагностирован стеноз (сужение) аорты. При этом, и у Чеда, и у Тиффани болезнь проявилась сравнительно поздно; так, у Тиффани старческие изменения начались примерно в 12 лет, когда большинство детей с прогерией уже являются глубокими стариками:

Генетическая основа прогерии
Из-за экстремально редкой встречаемости и неясной этиологии прогерия еще в XX веке абсолютно не поддавалась лечению, даже паллиативному. Но после того, как были локализованы гены, отвечающие за развитие прогерии, появилась не только возможность бороться с ней – но и понимание, что именно эти гены отвечают за физическое старение человека. Более того, прогерия демонстрирует, что физическое старение человека не имеет жесткой привязки к умственной и социальной деградации личности. Соответственно, скорректировав работу гена LMNA, можно как отсрочить или отменить старость, так и наладить «стабильное производство» стволовых клеток в организме.
Ген LMNA кодирует белок ламин А. Данный белок отвечает за образование ламины – оболочки, выстилающей внутреннюю поверхность клеточного ядра. При единичной мутации всего в одном кодоне, то есть, при замене ГГЦ (гуанин-гуанин-цитозин) на ГГТ (гуанин-гуанин-тимин), образуется дефектная версия ламина А, белок, называемый прогерином. Прогерин, в отличие от ламина, не встраивается в подложку ядра, и ядро теряет целостность. В результате возникает целая совокупность патологических изменений:
-
Нарушается репликация ДНК, поэтому клетки начинают стареть гораздо быстрее, чем положено (это явление называется «сенильность»)
-
ДНК выскальзывает за пределы ядра и за пределы клетки, из-за чего может запускаться аутоиммунная реакция
-
Нарушается стабильность генома, поэтому хаотически накапливаются другие мутации, которые с физиологической точки зрения напоминают старческие
-
В поврежденном ядре укорачиваются теломеры, что дополнительно ускоряет старение клетки
Прогерин, то есть, дефектный ламин А, с возрастом образуется и в обычных соматических клетках. Именно поэтому нарушается их репликация, теряется функция и сбиваются механизмы деления, что приводит к раку.
У детей с прогерией такие изменения особенно выражены в фибробластах (клетках кожи) и в клетках кровеносных сосудов. Именно поэтому основной причиной смерти при детской прогерии являются инфаркты и инсульты.
Если считать старение болезнью или совокупностью накапливающихся патологий, то основная сложность изучения такой болезни – в том, что она неравномерно и очень долго развивается. Именно детская прогерия показывает своеобразную «быструю перемотку» человеческого увядания, а на основе детской прогерии удалось получить и еще более стремительную модель этой болезни – мышиную. У мышей изучались в основном фибробласты (клетки кожи), клетки гладкой мышечной ткани, поджелудочной железы и клетки селезенки.
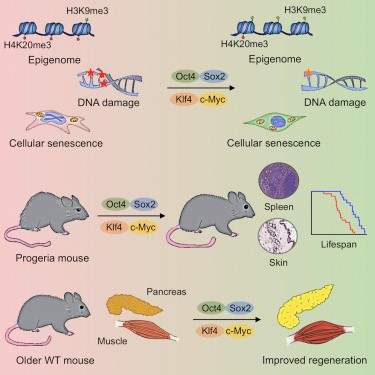
Исследование мышиных моделей прогерии привело к открытию удивительной возможности затормозить не только прогерию, но и старение. Были открыты четыре фактора транскрипции, блокирующих образование ламина-А: Oct4, Sox2, Klf4 и c-Myc. Эти факторы в 2006 году впервые получил японский ученый Синъя Яманака, в честь которого они также иногда именуются «факторами Яманаки». При внедрении четырех этих веществ в клетку в виде «кассеты», выработка ламина-А в клетке глушится, а сама соматическая клетка не только прекращает стареть, но и превращается в индуцированную плюрипотентную стволовую клетку. Индуцированные стволовые клетки, как и эмбриональные (эмбриональные стволовые клетки были открыты в 1998 году), могут превращаться в любые соматические клетки, в частности, «ремонтировать» ткань, поврежденную как прогерией, так и обычным старением.
Следует оговориться, что неконтролируемое внедрение кассет с OSKM также до добра не доводит: стволовые клетки возникают в огромном количестве и приводят к формированию тератом, злокачественных образований из эмбриональной ткани. Поэтому дозировку факторов транскрипции приходится тщательно контролировать и вводить их курсами, выдерживая между процедурами интервал в несколько часов.
Тем не менее, открытие этих факторов, получивших общее название OSKM, стало настоящим прорывом на пути к пониманию и лечению рака, а не только к пониманию старения. Синъя Яманака был удостоен за свое открытие Нобелевской премии по физиологии и медицине в 2012 году.
Лечение прогерии
Первые попытки лечить детскую прогерию предпринимались еще в 2006 году, также на мышиных моделях. Удалось воссоздать весь процесс поступления преламина-А (своеобразной «заготовки» для ламина-А) в ядро. Когда преламин-А направляется в ядро, к нему прикреплена молекула фарнезила, сигнализирующая, что данная молекула должна быть добавлена в оболочку, выстилающую внутреннюю поверхность ядра. Фарнезил выглядит как лишний «кончик» этой молекулы, и по прибытии в ядро должен быть отсечен, что делается при помощи фермента ZMPSTE24. У больных прогерией этот фермент не работает, фарнезил не отсекается, и именно из-за встраивания ламина А с фарнезилированными кончиками в оболочку ядра эта оболочка деформируется и теряет целостность.
В 2006 году впервые удалось затормозить развитие прогерии у мышей, у которых развитие этой болезни было специально спровоцировано. У них был заблокирован фермент фарнезилтрансфераза, подцепляющий фарнезильный кончик к ламину. В результате ламин лишился «опознавательного знака», и в клеточное ядро стала попадать лишь незначительная часть молекул этого белка. Это было сделано при помощи так называемых ингибиторов фарнезилтрансферазы (FTI), которые в целом токсичны для организма и замедляют рост клеток. Но именно благодаря этому свойству они применяются для угнетения раковых опухолей.
В ноябре 2020 года американское агентство по контролю над лекарственными препаратами и пищевыми добавками (FDA) наконец одобрило первый препарат, действующий именно таким образом. Он называется лонафариб и в среднем продлевает жизнь больных с прогерией на 2,5 года, то есть, на 15-20%.
Обнуление или разворот биологических часов, регулирующих обычное старение – значительно более сложная задача, рассказ о которой выходит за рамки этой публикации. Интересующимся я советую почитать об этом в книге Полины Лосевой «Против часовой стрелки» - именно эта книга и побудила меня после долгого отсутствия написать на столь тяжелую тему как прогерия. Как бы то ни было, вдумчивые обреченные дети-уродцы, дряхлеющие на глазах – настоящее воплощение неотвратимой смерти, и именно понимание их страданий открывает единственный реалистичный путь к победе над старостью, подталкивает трактовать старость именно как болезнь, а не как неизбежность. Поэтому они все-таки дают нам надежду, а также напоминают, как скоротечна жизнь, и как важно ценить ее во всех проявлениях.
Автор: Олег Сивченко






