
Давно пора поговорить о кратковременной памяти. Речь пойдёт о наиболее изученной её разновидности – рабочей памяти. Несмотря на то, что изложенное ниже является хорошо обоснованной теорией, в научных кругах остаются некоторые сомнения, и на страницах журналов происходят споры о том, что же считать субстратом рабочей памяти.
Рабочая, или оперативная, память – это разновидность кратковременной памяти, в которой информация удерживается, по разным оценкам, максимум до 20-30 секунд. Её назначение – формирование образа поступившего от органа чувств сенсорного стимула в то время, когда сам стимул уже исчез. Вот типичный пример её работы: вам надо срочно позвонить коллеге, но вы не знаете его/её телефон, спрашиваете у сидящих рядом и быстро (чтобы не забыть) набираете номер. После разговора вспомнить набранный номер вы уже не можете.
Предполагается, что за рабочую память отвечает префронтальная кора (PFC) – кора (кортекс), охватывающая лобные доли . PFC неоднородна и делится на несколько участков, отличающихся по функциональности. Среди них выделяют дорсолатеральный, медиальный и орбитофронтальный. С рабочей памятью связывают активность именно дорсолатеральной префронтальной коры (dlPFC).
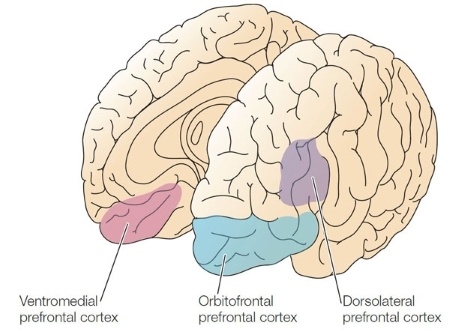
У человека префронтальная (да и в первом приближении любая другая) кора состоит из 6 слоёв нейронов. Важно, что нейроны разных слоёв, которые находятся непосредственно друг под другом, связаны и образуют миниколонки – так называемые миниколонки кортекса, которые хорошо различимы под микроскопом.
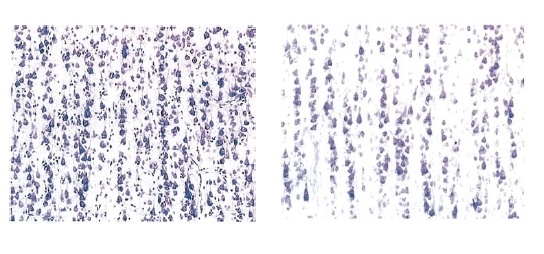
Миниколонки кортекса 9-летного (слева) и 67-летнего. Выводы, как говорится, делайте сами.
Считается, что миниколонка – это функциональная единица коры головного
Какое же участие принимают миниколонки dlPFC в работе оперативной памяти? Переходим на клеточный уровень.
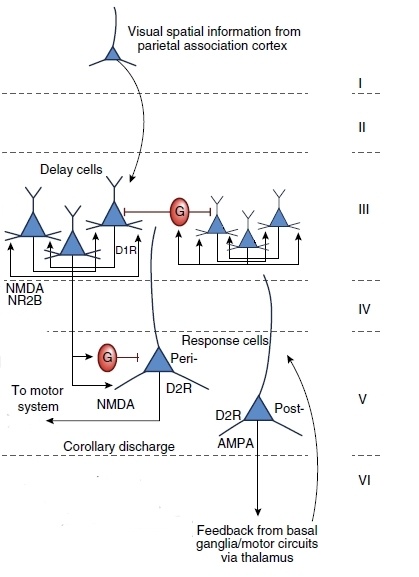
Увиденная или услышанная информация попадает в нейроны первого слоя миниколонки dlPFC и передаётся на её самый мощный у человека, третий слой, где расположено много пирамидных нейронов, их ещё называют delay cells, или клетки задержки. Пирамидные нейроны возбуждают друг друга, обмениваясь полученной информацией, — этот момент и есть работа оперативной памяти. Именно во время активности клеток задержки вы сохраняете в памяти информацию о набираемом номере. Передавая друг другу возбуждение, пирамидные клетки посредством вставочных ингибиторных нейронов (помечены на рисунке буквами G) дезактивируют работу других миниколонок, что предотвращает неправильное запоминание.
Кортикальная миниколонка имеет несколько выходов. Один из них – на моторную кору через нейроны 5-го слоя, клетки ответа, или response cells. Клетки моторной коры контролируют движение. В приведённом выше примере, очевидно, идёт команда пальцам набирать на диске кнопках телефона нужный номер. Второй выход, о котором я упомяну, раз не стёр с рисунка, — это так называемый сопутствующий разряд (corollary discharge) – сигнал, подаваемый клеткам
Интересным следствием наличия сопутствующего разряда является невозможность вызвать смех щекоткой самого себя. Предположим, вы всё же хотите это сделать. Но пальцам вместе с командой пощекотать передаётся и информация о грядущем двигательном акте:
Есть гипотеза, что из-за чрезмерной активности клеток ответа, которые регулируются D2-рецепторами, у больных психозами наблюдаются галлюцинации — своего рода искажённое эхо сенсорных стимулов. Подтверждением этой гипотезы служит тот факт, что галлюцинации проходят под действием нейролептиков, являющихся блокаторами D2-рецепторов.
Рассказанная мною упрощённая теория рабочей памяти ценна нам главным образом по одной причине — для понимания возможностей её фармакологической регуляции. Но для этого нам надо спуститься с клеточного уровня ещё ниже – на уровень молекулярный, чтобы выяснить, с какими биологическими мишенями могут связываться фармакологические агенты, которыми мы хотим модулировать нашу оперативную память. Для этого надо знать, как регулируется активность клеток задержки – тех самых пирамидных клеток 3-го слоя коры, взаимоподдерживаемая активность которых и составляет её работу.
Пирамидные клетки 3-го слоя выделяют для активации друг друга глутамат, действующий на NMDA-рецепторы, о которых шла речь в статье о долговременной потенциации. Если вы помните, эти рецепторы являются как лиганд-, так и потенциалзависимыми, то есть для открытия их ионного канала одного глутамата недостаточно – надо изменить потенциал клеточной мембраны рядом с ними, чтобы вытолкнуть заглушку из ионов магния. Но если в ходе долговременной потенциации такую функцию выполняют другие глутаматные рецепторы – AMPA-рецепторы, то в случае акта оперативной памяти работают (преимущественно) никотиновые ацетилхолиновые рецепторы α7-подтипа, которые обозначаются α7-nAChR.
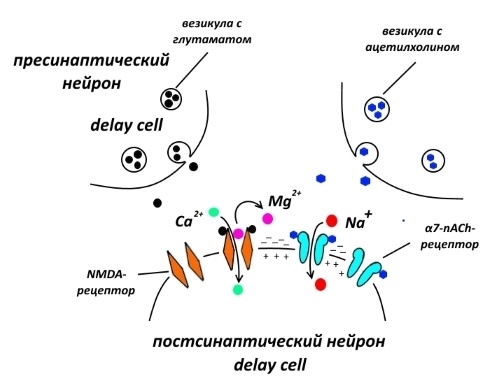
Интересно, что люди, страдающие шизофренией, при которой, как полагают, работа PFC нарушена, часто сильно курят. Согласно одной из гипотез, у курящих пациентов никотин улучшает функционирование dlPFC, стимулируя α7-nAChR. Есть, правда, и другие гипотезы.
Но на дендритных шипиках пирамидных клеток dlPFC, формирующих синапсы и обеспечивающих функционирование рабочей памяти, есть не только α7-nAChR, но и D1-дофаминовые рецепторы. Зачем там нужны они? Очевидно, они принимают сигналы, подаваемые дофаминергическими нейронами, которых в PFC очень много.
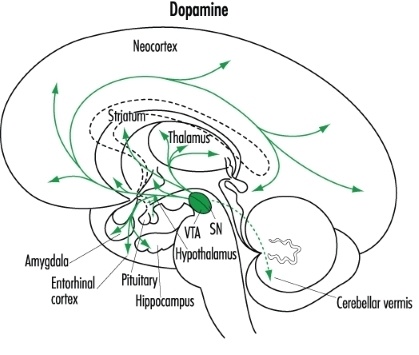
Дофаминергический тракт. Обратите внимание на проекции вентральной области покрышки (VTA), одного из скоплений дофаминергических нейронов, в кору (neocortex).
Оказалось, что дофамин имеет на функциональное состояние dlPFC серьёзное влияние: в его отсутствие этот участок
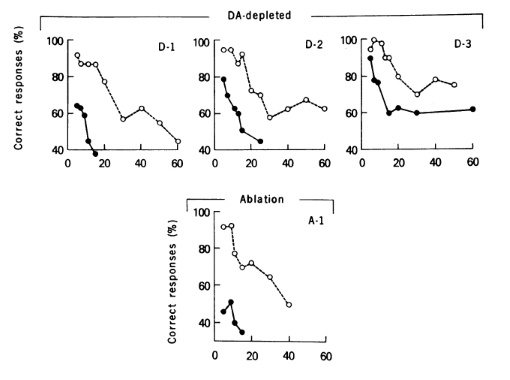
На рисунке показана зависимость числа правильных ответов (correct responses) в тесте на рабочую память от времени задержки в секундах (времени между предъявлением стимула и его воспроизведением) у макак, которым токсином разрушили дофаминергические нейроны префронтальной коры (DA-depleted) или хирургическим путём удалили (Ablation) часть префронтальной коры (principle sulcus), ответственной за рабочую память. Белые кружки – до операции, чёрные – после.
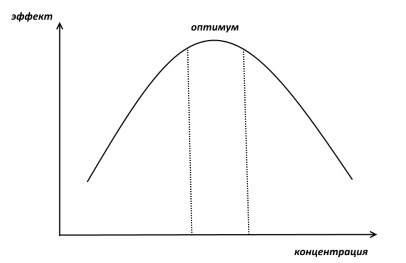
Похожая картина, т.е. ухудшение памяти, возникает при избытке дофамина, который выделяется, к примеру, при сильном стрессе. Таким образом, для нормального функционирования префронтальной коры и рабочей памяти нужен некий промежуточный, не низкий и не высокий, уровень дофамина. Фармакологи в таком случае говорят, что зависимость эффекта дофамина от его концентрации носит инвертированный U-образный характер.
Продемонстрирую вам результаты лайт-версии эксперимента, полная версия которого и позволила выяснить все детали функционирования рабочей памяти. Этот эксперимент носит название окуломоторный тест на задержанную реакцию (oculomotor delayed-response test), проводят его на высших приматах – обезьянах.
Суть лайт-версии теста в следующем.
Обезьяна в течение долей секунды следит за центральной мишенью на мониторе. Далее в его противоположных концах (слева или справа) показывают вторую мишень. Мишень пропадает на несколько секунд, после чего животное должно совершить движение глазами ту сторону, в которой ранее была вторая мишень. Движения глаз (они называются саккады) фиксируются. Если саккада совершена в сторону, где мишени на самом деле не было, то это считается ошибкой.

В платной полной версии теста мишень случайным образом показывают в 8 местах монитора, расположенных на окружности на равном расстоянии друг от друга.
Нейроны 3-го слоя dlPFC, клетки задержки, включаются, когда вторая мишень пропадает, именно они создают образ мишени и хранят его в рабочей памяти. Клетки ответа, напротив, активируются в момент совершения саккады.
Итак, если ввести в
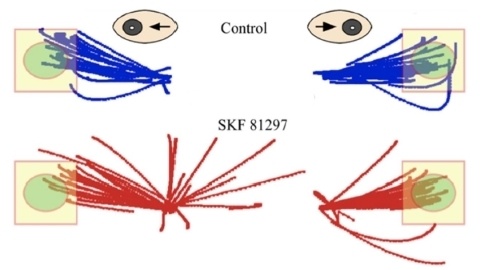
Синим цветом окрашены саккады до введения агониста D1-рецептора (SKF 81297), красным – после. Поскольку агонист вводился только в одно полушарие, то ошибки возникали в основном при появлении мишени в левой части монитора.
Вдали от синаптической щели, ближе к основанию дендритного шипика, D1-рецепторы контролируют работу ионных каналов 2 типов: HCN (управляемые циклическими нуклеотидами гиперполяризационно-активируемые каналы или hyperpolarization-activated cyclic nucleotide-gated) и KCNQ (калиевые потенциал-зависимые каналы семейства KQT или potassium voltage-gated channel subfamily KQT).
Вот как это происходит.
Связывание D1-рецептора с дофамином, т.е. его естественным лигандом, запускает цепочку биохимических событий. Во-первых, дофаминовый рецептор через сопряжённый с ним G-белок активирует аденилатциклазу – фермент, превращающий аденозинтрифосфат (ATP) в циклический аденозинмонофосфат (cAMP). Что дальше – догадываетесь? HCN-каналы управляются циклическими нуклеотидами, одним из которых и является cAMP. Молекулы cAMP присоединяются к С-концам белка, составляющего субъединицы этого канала, что вызывает его открытие, и положительные ионы (главным образом калия) вытекают наружу.
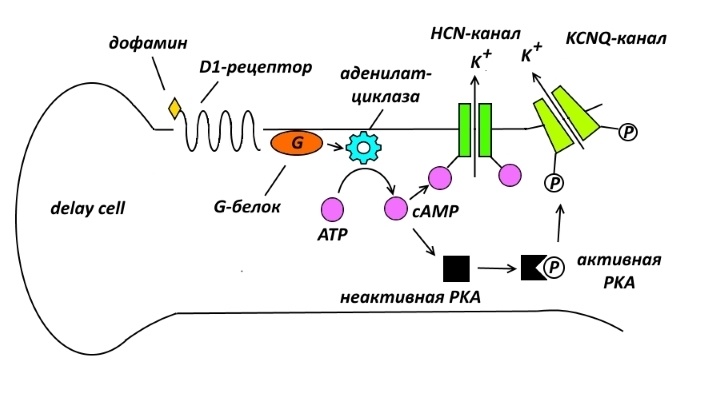
К чему это приводит? Это приводит к тому, что положительные заряды, заботливо накопленные клеткой задержки посредством активации NMDA- и α7-nACh-рецепторов и могущие вызвать потенциал действия, предательски покидают эту клетку, и начавшая было деполяризация стопорится – возбуждения нейрона не происходит, а, следовательно, не работает и оперативная память.
KCNQ также открываются при сверхактивации D1-рецепторов, но с той разницей, что их работа по выкачиванию положительного заряда происходит под действием cAMP не напрямую, а через протеинкиназу А – фермент, который, если вы помните, присоединяет к белку (в данном случае, к белку, формирующему ионный канал) фосфатные группы.
Но почему же тогда угнетается рабочая память, если дофамин в недостатке?
Есть несколько объяснений.
Во-первых, как мне рассказала исследовательница, в чьей лаборатории было открыто всё то, о чём я рассказываю выше, миниколонки кортекса защищены от влияния других таких же миниколонок ингибиторными нейронами не на все сто: вполне вероятно паразитное возбуждение, так называемый шум. Показано, что умеренная активация D1-рецепторов, ведущая к открытию части HCN- и KCNQ-каналов, позволяет этот шум отсечь. На физиологическом уровне появление шума означает, что запоминается неверная информация. Грубо говоря, если вам сообщили номер телефона 555-234-891, то может запомниться 555-234-821.
Во-вторых, имеются данные, что без активации D1-рецепторов невозможна работа образованного клетками задержки синапса, потому что без дофамина на постсинаптической мембране оказывается очень мало NMDA-рецепторов.
Так же, как и в случае AMPA-рецепторов, о чём я уже писал, часть NMDA-рецепторов покоится в эндоплазматическом ретикулуме и не вовлечена в синаптические процессы. Сложный биохимический каскад, подробности которого сейчас активно изучаются, приводит к тому, что под действием дофамина происходит фосфорилирование NMDA-рецепторов. Фосфорилированные рецепторы выходят на поверхность клеточной мембраны в районе синаптической щели и включаются в работу.
Для тех, кто интересуется, распишу немного этот каскад.
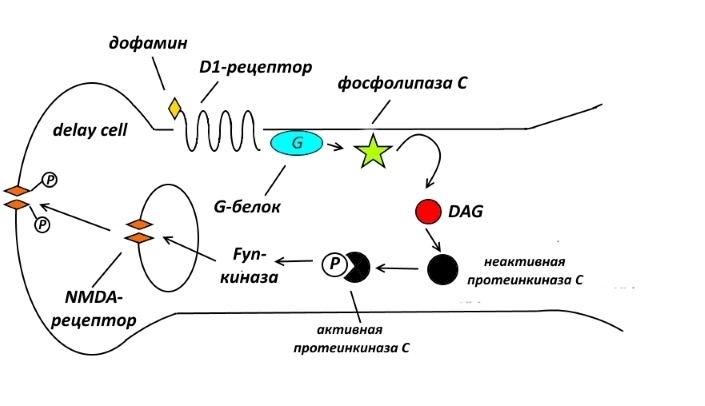
И на этот раз связывание дофамина с D1-рецептором приводит к активации G-белка, но другого. Этот белок приводит в действие заякоренную в мембране фосфолипазу С, которая слегка чикает триглицериды этой мембраны до диацилглицерина (DAG) – глицерина, этерифицированного всего 2 остатками жирной кислоты. DAG – это, как и cAMP, вторичный посредник, который запускает протеинкиназу. Но не протеинкиназу A, которую включает cAMP, а протеинкиназу С. Она, в свою очередь, фосфорилирует другую протеинкиназу – Fyn-киназу, которая прямо или опосредованно фосфорилирует спрятанные в эндоплазматическом ретикулуме NMDA-рецепторы. Фосфорилирование работает в данном случае как антиякорь, заставляющий всплыть глутаматный рецептор в синапс. Всплывший рецептор начинает генерировать спайки. Profit!
Такая же инвертированная U-образная зависимость активности клеток задержки от концентрации наблюдается и для другого катехоламина – норадреналина.
При малых концентрациях норадреналин связывается с α2A-адренорецепторами, которые подавляют активность фермента аденилатциклазы, продукция cAMP снижается, HCN- и KCNQ-каналы не открываются, положительный заряд из нейрона не утекает, потенциал действия генерируется.
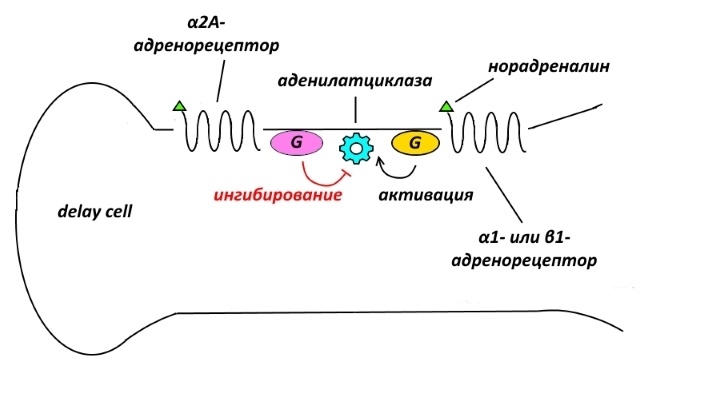
При больших концентрациях норадреналин начинает связываться с имеющими к нему меньшее сродство α1- и β1-адренорецепторами, которые аденилатциклазу активируют. В результате через HCN- и KCNQ-каналы из клетки утекает калий, способность к деполяризации, т.е. к возбуждению, падает – рабочая память угнетается.
Вероятно, в первобытную эпоху дезактивация PFC под действием стресса, в ходе которого в
Таким образом, поддержание возбуждения клеток задержки, активность которых и есть рабочая память, определяется работой NMDA- и α7-nACh-рецепторов. Функционирование этих нейронов также регулируется дофаминергической и норадренергической системами, которые в зависимости от ситуации ослабляют либо усиливают синаптические связи между пирамидными клетками дорсолатеральной префронтальной коры.
Продолжение следует.
Автор: superhimik






