Представляем гостевой пост студентов Санкт-Петербургского государственного электротехнического университета «ЛЭТИ» им. В. И. Ульянова (Ленина).
Всем доброго времени суток! Мы студенты «ЛЭТИ» Овсепьян Артур (Artsearcher) и Квиндт Павел (Paul_Quindt). Всю нашу осознанную деятельность в университете мы посвятили работе с 3D моделями анатомических структур человеческого организма и их биомеханическому анализу под руководством профессора, доктора технических наук Бегуна Петра Иосифовича, доцента, кандидата технических наук Лебедевой Елены Александровны, ассистента, кандидата технических наук Пустозерова Евгения Анатольевича.
Для чего это нужно?
Во-первых, информация, получаемая классическими методами визуализации анатомических структур, такими как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ангиография чаще всего используется частично и оценивается врачами качественно. В то же время процессы, фиксируемые этими методами, несут информацию, которая, в частности, связана с объяснением природы возникновения патологий структур человека.
По нашим представлениям, понять природу патологий по изображению вряд ли возможно. Но в совокупности с математическим моделированием эта задача реальная.
Во-вторых, биомеханическое моделирование нашло широкое применение в предоперационном планировании, реабилитации и планировании лучевой терапии. Современные методы визуализации и анализа дают возможность предварительно оценить исход операции.
Рассмотрим это на примере.
Перед нами стоит задача устранить патологическое сужение органа (сосуд, дыхательные пути, пищевод) с помощью раздуваемого баллона (баллонная ангиопластика). Неплохо было бы знать, насколько раздувать баллон. Этот процесс можно смоделировать и выявить оптимальные значения давления в баллоне, при которых не произойдет разрыв структур органа либо ремиссия. Данный вопрос является частью предоперационного планирования, который особенно актуален при патологиях сердечных клапанов.
Но, казалось бы, смоделировали ситуацию, получили значения и всё, применяем методику. Нет, индивидуальное строение структур пациента требует индивидуальный подход к моделированию.
К сожалению, предшествующие математическому анализу шаги, да и сам анализ лежат за пределами знаний большинства врачей, а медицинские знания недоступны специалистам, владеющим математическим аппаратом. Тут-то на сцену выходим мы [фанфары]. Конечно, мы не претендуем на звание асов в двух этих сферах, но точками соприкосновения назваться можем.
Этапы биомеханического анализа
В принципе, если не учитывать постановку глобальной задачи, то биомеханический анализ можно разделить на три этапа:
- Создание модели.
- Введение допущений и задание граничных условий.
- Математический анализ.
Под допущениями мы подразумеваем невозможность учесть все параметры рассматриваемой модели. Банально, практически все ткани организма анизотропны, мы уже не говорим про биохимическую природу большинства процессов в организме, которая описывается атомарными и молекулярными моделями. Так что в любую биомеханическую модель вводят ряд допущений, чтобы снизить её сложность, но, логично, чем допущений меньше, тем модель адекватнее.
Теперь о граничных условиях. Математические вычисления мы производим в CAE-пакетах (Computer aided engineering) Abaqus, Ansys, Nastran, Cosmos, LS-dyna и прочих, в зависимости от типа задачи. Все эти пакеты основаны на конечно-элементных решателях, которые предназначены для решения краевой задачи (она же граничная) для систем дифференциальных уравнений. Введение граничных условий необходимо для нахождения единственного решения на границе рассматриваемой области.
Эту статью мы решили посвятить первому этапу биомеханического анализа – созданию модели анатомической структуры человека, как биологического объекта.
Моделирование
Для начала, нам следует ознакомиться с основными способами создания 3D моделей анатомических структур.
Начнем с основ. У большинства людей, при упоминании слов «построение» и «3D модель» в голове сразу возникает такая последовательность действий:
- Выбор объекта.
- Изучение геометрии.
- Создание виртуального образа объекта по его геометрическим параметрам.
Однако, при работе с анатомическими структурами, при таком подходе, возникает ряд проблем:
Во-первых – недоступность. Чаще всего, мы не можем своими глазами увидеть нужный нам орган. Геометрические параметры и механические свойства тканей приходится изучать путем всякого рода визуализации, или с помощью препарирования.
Во-вторых, геометрия исследуемых объектов, чаще всего, очень сложна, из-за чего приходится вводить упрощения в построении, а это ведет к уменьшению достоверности исследования.
В-третьих – время. Применение такого способа для создания моделей анатомических структур требует больших затрат сил и времени, в связи с индивидуальностью каждого объекта исследования.
На рисунках ниже 3D модели внутренних органов человека: сосуды виллизиева круга и аортальный клапан (а – вид спереди, б – вид сверху в разрезе), построенные нами и нашими коллегами вручную, применяя различные САПР (чаще всего SolidWorks). Как видите, они не являются достаточно естественными, хоть мы и старались учесть максимум аспектов.
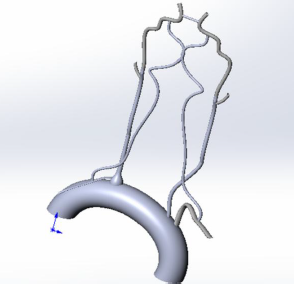
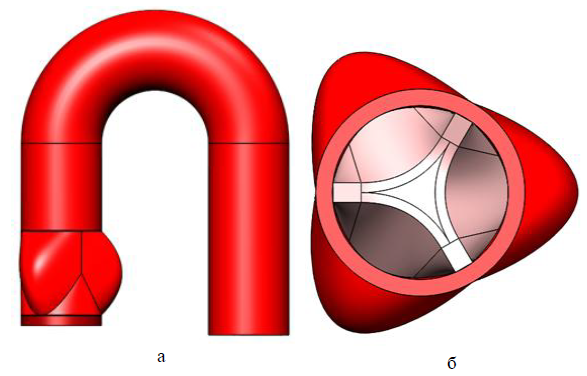
А ведь это ещё далеко не самые сложные структуры человеческого организма. Если, к примеру, вы захотите исследовать целый орган, например, почку или печень, боимся даже представить, сколько времени у вас займет подобное построение, с учетом всех особенностей органа. И мы не уверены, что на выходе у вас получится достаточно достоверная модель, результаты исследования которой, могут быть применимы к реальным объектам.
Всё плохо?
Нет! Существует альтернативный способ построения моделей – реконструкция по КТ. Вообще, КТ представляет собой распределение рентгеновской плотности (Шкала Хаунсфилда) и чем тканиевая структура плотнее, тем соответствующая ей зона на КТ ярче.
Томографы позволяют получить изображения в формате DICOM (срезы) с каким-то шагом (чем томограф современнее, тем шаг меньше), а это в свою очередь дает возможность реконструировать полигональную модель. Реконструкция полигональной модели практически всегда реализуется посредством алгоритма марширующих кубов. Так сложилось, что полигональные модели для удобства конвертируют в STL-файл. Чтобы это сделать, необходимо триангулировать полигональную модель.
Существует программное обеспечение для этих нужд, и самое известное – Mimics Materialise. Это линейка продуктов, в которых реализовано множество инструментов для сегментации, генерации трехмерных моделей с конвертацией в STL-файл и даже предоперационного планирования.
Но у нас с этим ПО не сложилось. Причина сугубо субъективная – неудобный инструментарий для сегментации в режиме 3D.
Выход из ситуации
Так как мы не медики и нам проще ориентироваться по 3D моделям, то для нас лучше как можно быстрее перейти от снимков КТ к 3D визуализации.
Перед нами стояла задача: исследовать газодинамику верхних дыхательных путей. Для этого требовалось найти базу снимков КТ, реконструировать и сегментировать зону интереса, сгенерировать STL-файл и импортировать его в CAE-пакет.
С первым и последним всё понятно: за снимками к медикам, за анализом к Abaqus, а вот с решением вопросов по сегментации и качественной триангуляции пришлось повозиться.
Для подобного рода операций существуют специальные программы – DICOM-Viewer’ы. Мы обращались к различным решениям, но все они, по той или иной причине, не удовлетворяли нашим запросам.
И тут, в процессе поиска, мы наткнулись на статью Dicom – взгляд изнутри. Статья посвящена продукту Inobitec DICOM-Viewer российской компании ИНОБИТЕК, и было принято решение остановиться на нем. Этот Просмотрщик полностью подошел под заявленные выше цели. По нашему субъективному мнению, данный Viewer дает на выходе лучшее качество модели и сетки, которое нам доводилось видеть. К тому же он предоставляется на русском языке.
Ниже иллюстрируется пример модели передней брюшной стенки, полученной при помощи Inobitec DICOM-Viewer’а.
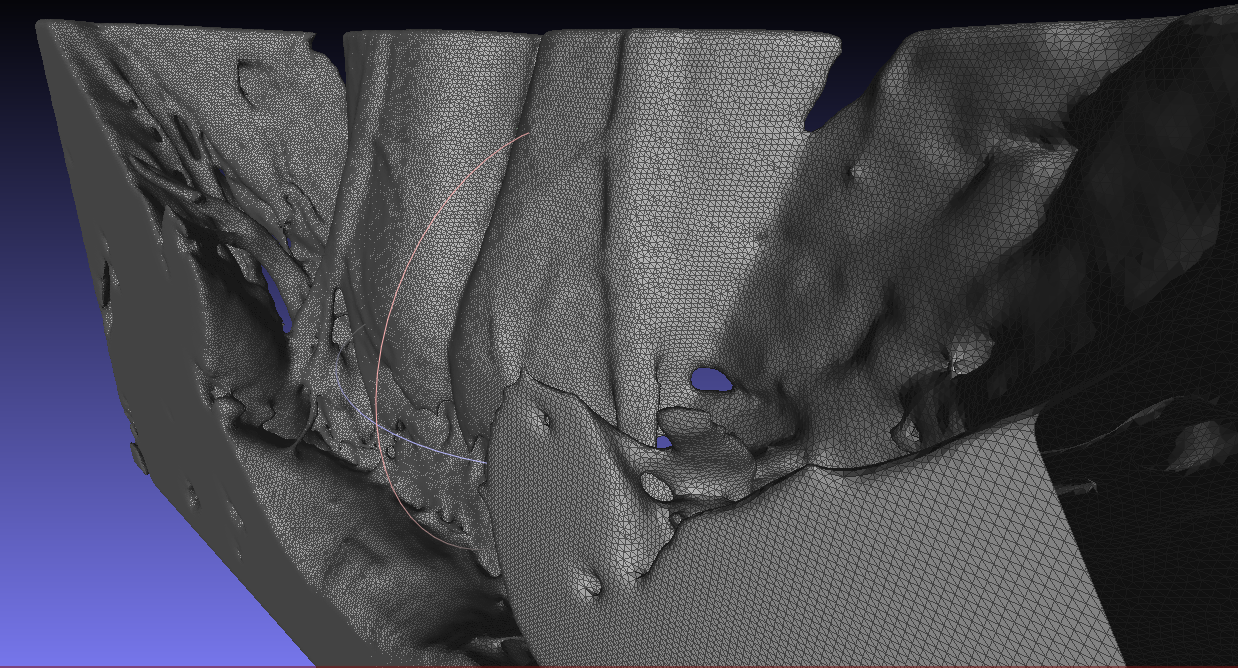
Однако, в редких случаях, STL-файл не сразу пригоден к импорту после его генерации, тогда мы корректируем сетку в ПО MeshLab и дальше конвертируем STL-файл в STEP-файл. Файлы этого формата пригодны для чтения почти всеми CAE-пакетами.
От теории к практике
Вкратце покажем решение одной из задач с верхними дыхательными путями. Допустим, пациент с синдромом обструктивного апноэ сна. За счет снижения общего тонуса верхних дыхательных путей, происходит так называемое спадение дыхательной трассы (уменьшение исходного диаметра дыхательных путей). При запущенной форме апноэ есть вероятность, что при вдохе произойдет коллапс (полное спадение) верхних дыхательных путей и легочная вентиляция прекратится, при этом попытки сделать вдох будут продолжаться, из-за чего человек не сможет дышать какой-то промежуток времени.
Нам необходимо сымитировать и исследовать условия схлопывания.
Начнем с создания 3D модели. В данной статье мы рассмотрим два пути сегментации из представленных в Inobitec DICOM-Viewer’е:
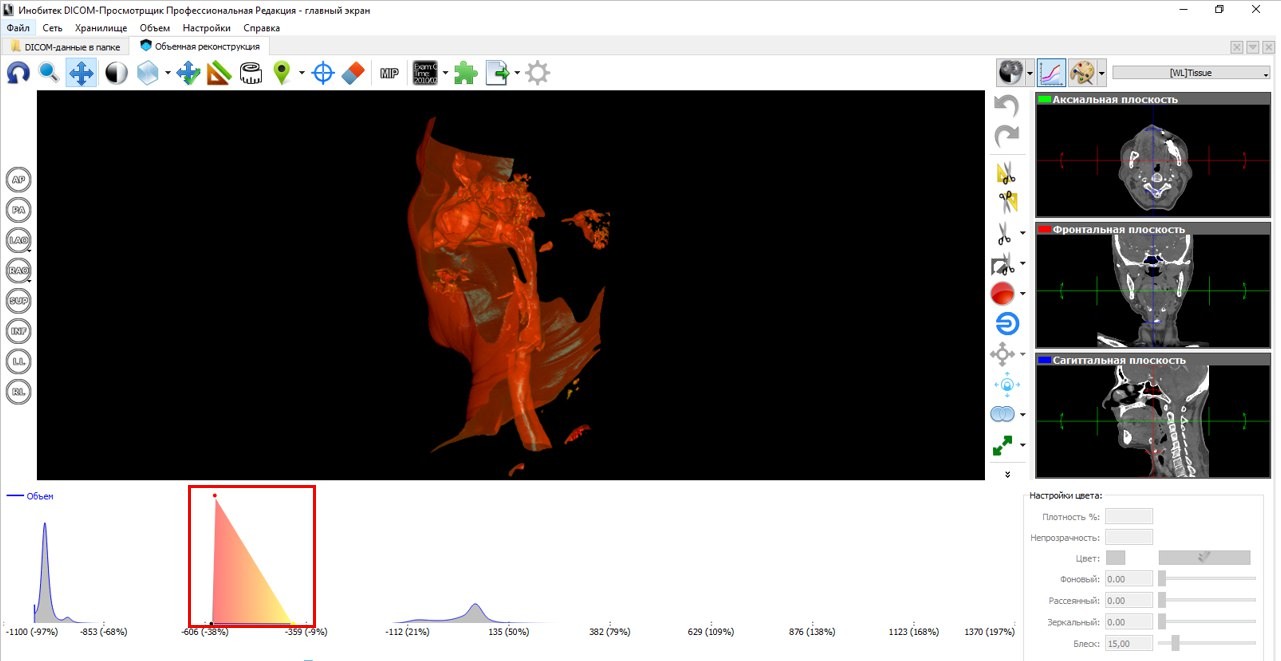
На рисунках ниже проиллюстрирован принцип с послойным выделением зоны интереса, как в Mimics Materialise. В режиме мультипланарной реконструкции мы устанавливаем порог для интенсивности, тем самым срезая большинство не интересующих нас структур.
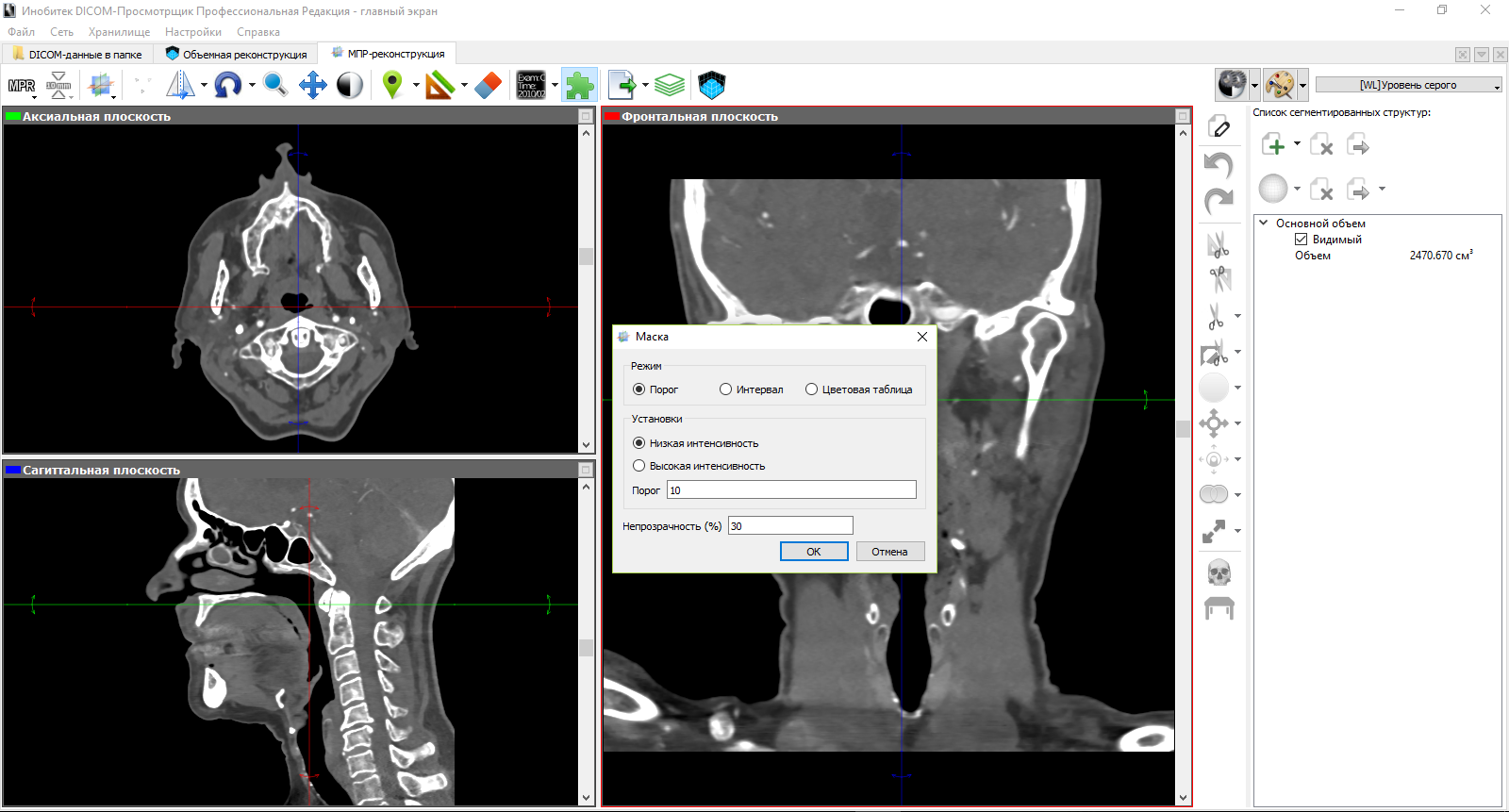
Далее, мы принимаемся за ручную сегментацию. На рисунке ниже мы иллюстрируем сегментацию на фронтальной плоскости с помощью инструмента «наращивание». Параметры для этого инструмента включают в себя изменение площади и шага сегментации. На сагиттальной и аксиальной плоскостях видны сегментированные слои, соответствующие выделенной структуре на фронтальной плоскости.
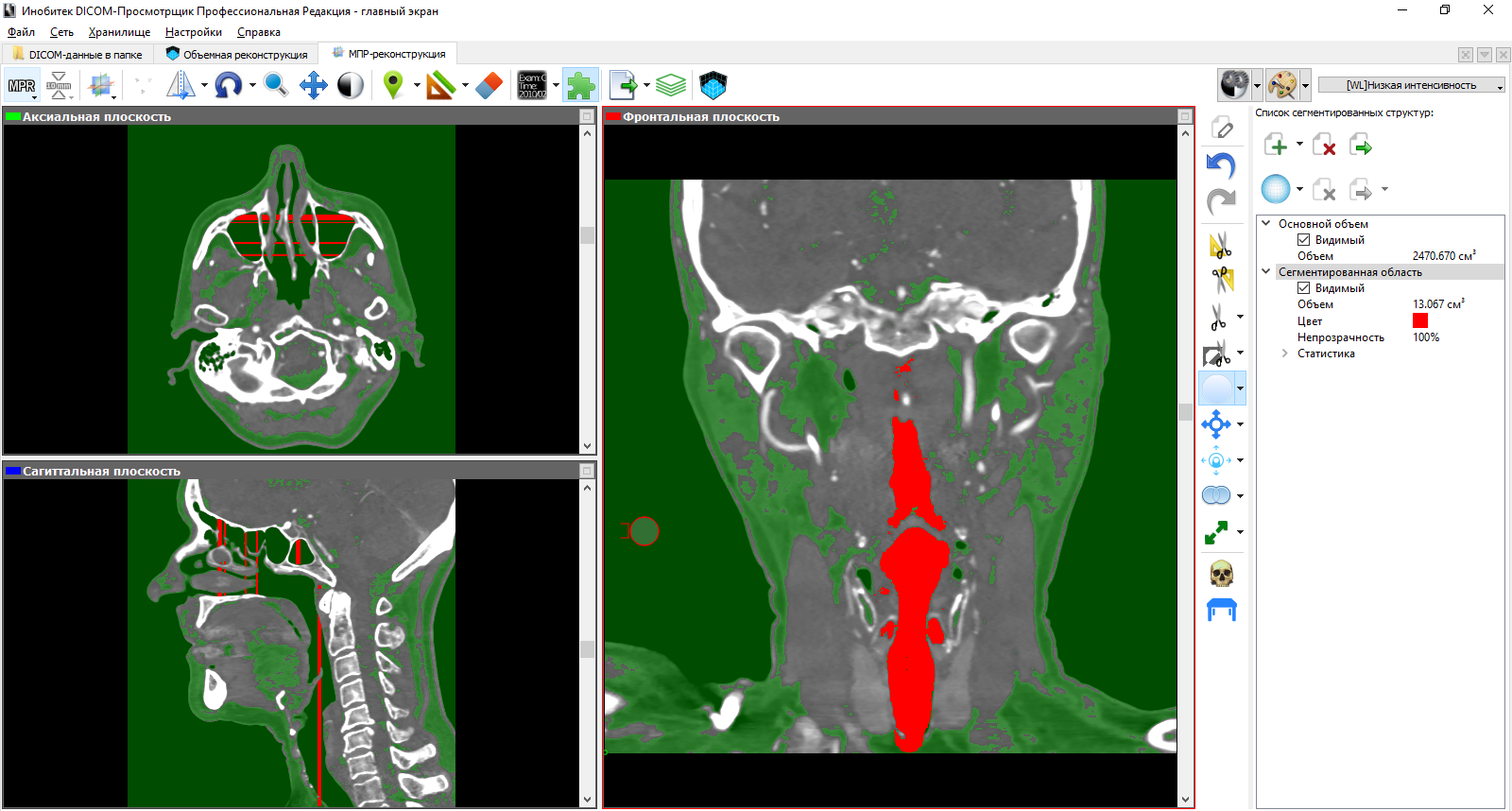
В конечном итоге, мы получаем новый набор срезов КТ с сегментированной структурой и только. Подход к сегментации с этой стороны оставляет желать лучшего, так как приходится тратить кучу времени.
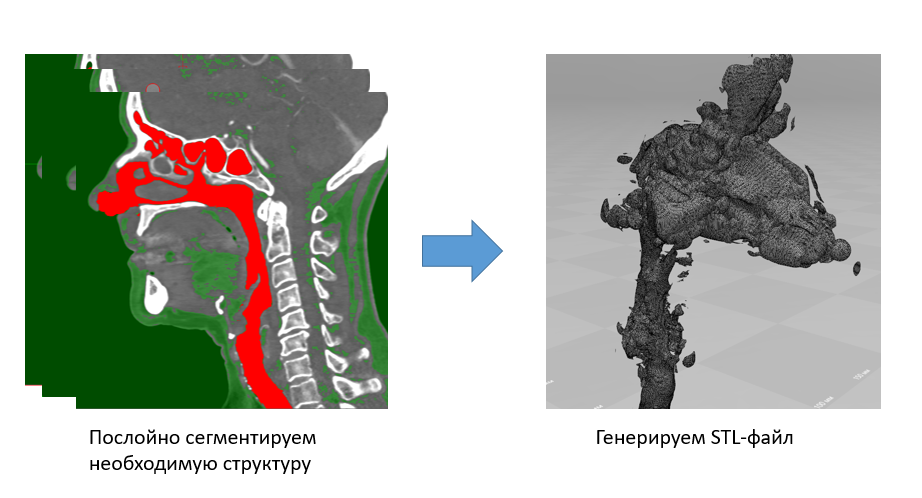
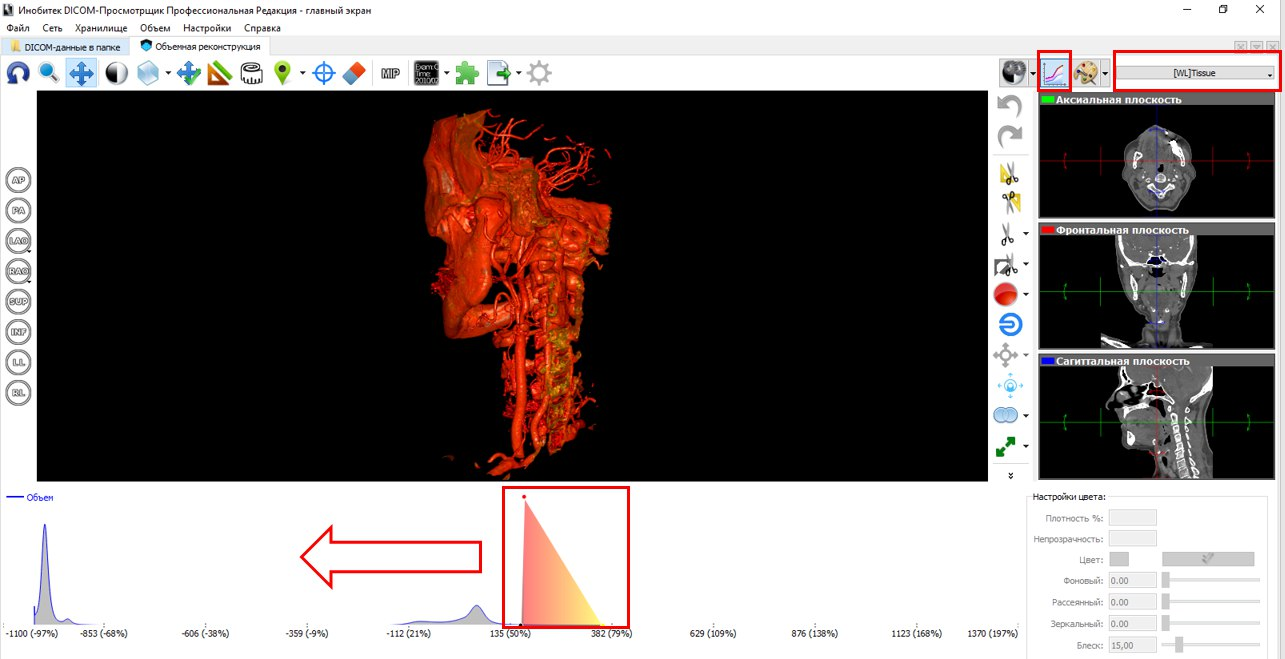
А вот сегментация по трехмерной модели – дело другое. Как минимум, нам гораздо проще ориентироваться по ней. Без преувеличения, мы в разы экономим свое время. Если в первом случае мы устанавливаем один порог интенсивности и в ручную выделяем зону интереса, то в случае с 3D сегментацией мы изменяем передаточную характеристику визуализации 3D изображения и дальше вручную удаляем ненужные сегменты.
На следующем рисунке слева изображен сегмент дыхательных путей, включая носовую и ротовую часть глотки, надгортанник, вход в гортань и часть трахеи. На наш взгляд, количество артефактов сегментации в полученных STL-файлах минимально. Но самое главное – качество сетки. Мы считаем, в Inobitec DICOM-Viewer’e реализован отличный алгоритм триангуляции.
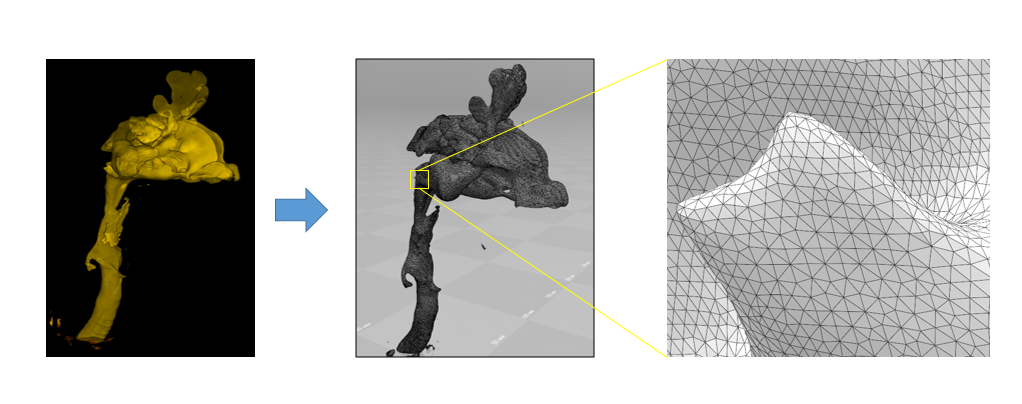
Собственно, модель получили. Что дальше?
По сути, перед нами связная задача – за счет отрицательного давления, создаваемого в легких на вдохе, просвет дыхательной трассы сужается. Мы решаем такие задачи в CAE-пакете Abaqus, но в принципе, их можно и в других, где есть FSI (Fluid–structure interaction). Демонстрации ради, мы попробуем смоделировать первые 0,3 секунды вдоха, чтобы проследить сужение просвета дыхательных путей. На вход модели (со стороны легких) прикладываем отрицательное давление, на выход – значение скорости, равное нулю. Чтобы сэкономить время, мы упростили модель, убрав часть носовой полости, и введя большой ряд допущений (изотропность, фиксация только входной и выходной граней, отсутствие преднапряженных состояний, постоянное значение давления), однако это не полностью исказит действительность.
Результаты анализа
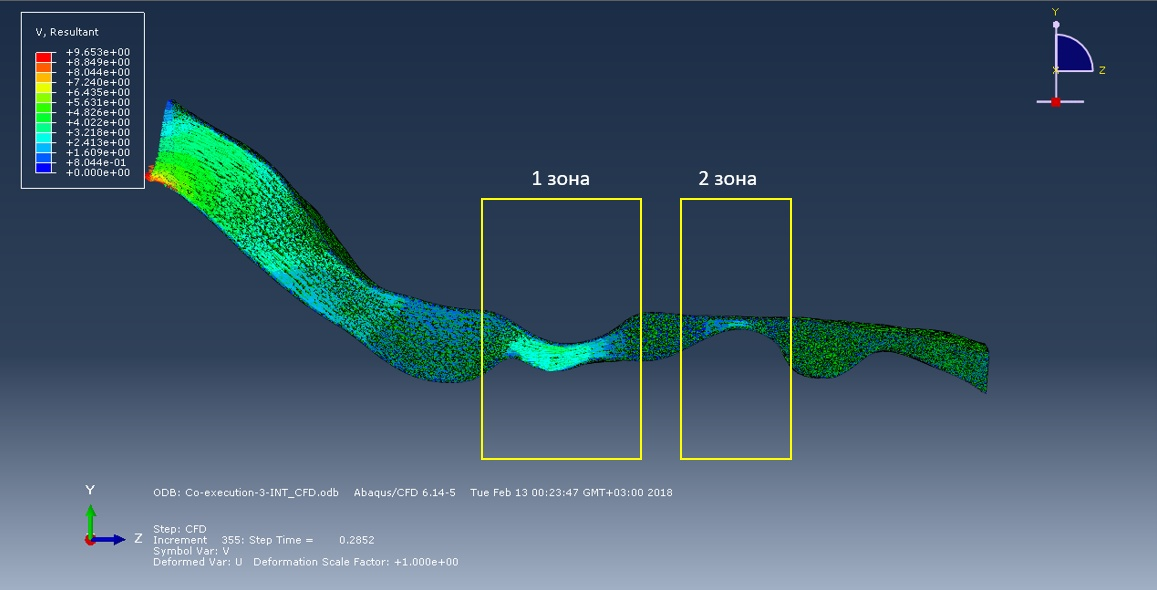
Итак, на рисунке ниже изображена картина пространственных перемещений поверхности дыхательной трассы и их скорость в момент времени 0,25 секунды. Поток, создаваемый отрицательным давлением «стягивает» стенки дыхательной трассы внутри.
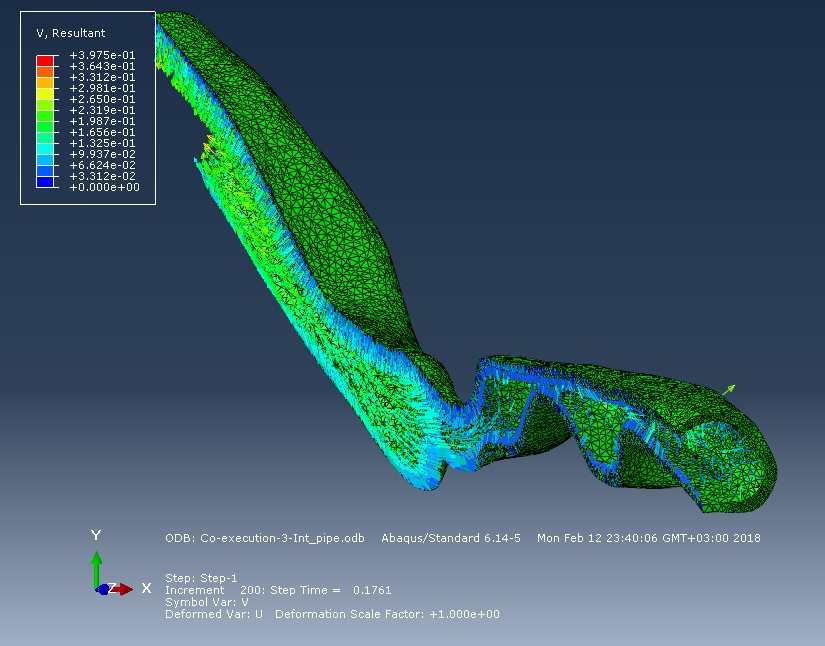
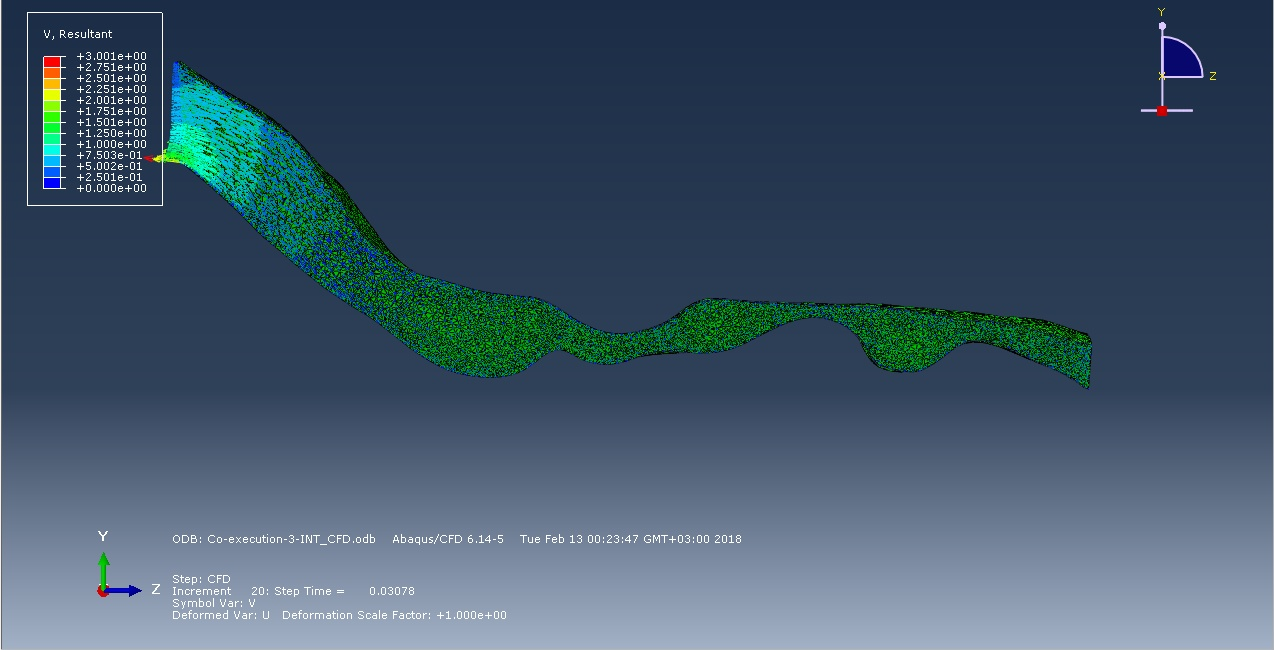
На следующих рисунках представлены эпюры потока воздуха практически вначале фазы вдоха и к 0,3 секунде вдоха. По логике вещей, чем меньше сечение, тем быстрее поток, следовательно, и вероятность коллапса в этом участке больше. Но моделирование первых 0,3 секунд вдоха показало, что в зоне 2 скорость потока меньше, чем в зоне 1, несмотря на диаметр сечения дыхательной трассы. В будущем мы планируем исследовать полный дыхательный цикл.
Заключение
В этой статье мы не претендуем на адекватность в постановке задачи. Мы в первую очередь хотим познакомить вас с деятельностью, которой занимаемся каждый день, и методикой, которую мы используем для создания трехмерных моделей. А также, донести, что если грамотно подходить к постановке и решению задачи, эта деятельность переходит в серьезную науку, связывающую врачей и инженеров, отчасти проливая свет на великое разнообразие процессов внутри нас.
Может кто-то откроет для себя новое интересное направление, найдет креативное применение нашим знаниям в других сферах науки и производства, а кто-то просто с интересом прочитает нашу работу.
Если такое произойдет, мы с удовольствием будем открывать для вас новые возможности биомеханики в следующих статьях.
Всем спасибо и удачи!
Литература:
- Бегун П. И., Шукейло Ю. А. Биомеханика. – СПб.: Политехника, 2012. – 463 c.
- Бегун П. И., Афонин П. Н. Моделирование в биомеханике. Учебное пособие // М.: Высшая школа. – 2004. – 391 c.
- Башарова Г. Т., Башарова Д. Т. Исследование потока крови при атеросклеротическом поражении внутренней сонной артерии // Неделя науки СПбПУ 13-19 ноября 2017 (ИПММ) – С. 267–2.
- A. L. Ovsepian, A. A. Anisimov, E. V. Lebedeva, Trong Huu Tran. The technique of internal bodies research // XX IEEE International Conference on Soft Computing and Measurements (SCM) – 2017. – C. 159–161.
- П. А. Квиндт, А. Л. Овсепьян, А. И. Аль-Кисвани, П. И. Бегун. Биомеханические исследования состояния структур стенозированного аортального клапана при баллонной дилатации // Известия СПбГЭТУ «ЛЭТИ» – 2018. – №1. – С. 77–82.
Автор: Роман Силецкий




