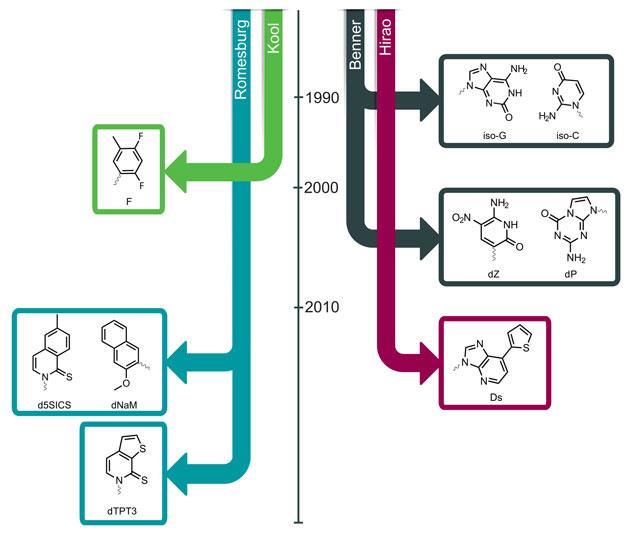
Одним из важнейших и самых узнаваемых изображений в истории науки XX века является двойная спираль ДНК. Старина Джеймс Уотсон, в конце жизни сильно сдавший, а до этого постепенно вытесненный и низложенный из рядов неолиберального научного сообщества за острую и непримиримую гражданскую позицию, имеет все шансы отметить в начале апреля свой 97-й день рождения. Он пережил своего прославленного коллегу Френсиса Крика более чем на 20 лет и не только стал первым человеком, чей геном был полностью секвенирован (это произошло в 2007 году), но и в полной мере застал новую эпоху, в которую нуклеотидные цепочки не только редактируются, но и конструируются с нуля. Ниже я расскажу о некоторых опытах по расширению генетического алфавита ДНК и о создании нуклеиновых кислот с расширенным набором нуклеотидов. Такие исследования восходят к середине 1980-х, когда ими независимо занялись биолог Стивен Беннер, биохимик Эрик Кул, биохимик Флойд Ромсберг, а также некоторые другие учёные. Для контекста приведу взятую отсюда инфографику, которая иллюстрирует хронологию описываемых исследований.
В основе эволюции лежит принцип «выживает наиболее приспособленный», и самый базовый уровень живой материи, на котором сохраняется этот принцип – это устройство нуклеиновых кислот. Молекула ДНК обладает достаточной прочностью, чтобы сохранять целостность и при этом служить шаблоном для сборки белков. Четыре азотистых основания (нуклеотиды) формируют двойную спираль по принципу комплементарности (взаимного встраивания). Поэтому молекулы ДНК могут иметь разную длину в зависимости от того, какому организму принадлежат, но всё равно работают по одинаковому принципу и служат для формирования принципиально схожих белков. Четыре нуклеотида, входящих в состав ДНК – аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). Благодаря комплементарности, Ц всегда соединяется с Г, а А – с Т. Поэтому одна спираль ДНК служит шаблоном для другой, и на основе одной цепочки ДНК всегда можно достроить другую. Эти процессы находятся на стыке информатики и биологии, информационное осмысление алфавита ДНК – фундаментальная тема, не раз поднимавшаяся на Хабре. Одна из самых фундаментальных статей, описывающих реализацию трёхмерного ДНК-подобного движка в коде, вышла в конце 2020 года, принадлежит уважаемому Ярославу Сергиенко @pallada92. Тем не менее, комплементарность присуща не только естественным азотистым основаниям.

Эта демонстрационная модель напоминает, почему молекула ДНК у любых организмов имеет форму двойной спирали. Нуклеотиды, входящие в её состав, соединяются строго со своими парными нуклеотидами: гуанин с цитозином и тимин с аденином. Подставить на место этих нуклеотидов другие компоненты практически невозможно (если мы подразумеваем дальнейшее нормальное копирование и репликацию расширенной ДНК), однако их можно вставлять попарно. В таком случае, если уподобить молекулу ДНК лестнице, в ней появятся новые «ступеньки», и теоретически это позволит обогатить передаваемый генетический материал с сохранением структуры двойной спирали, а также с сохранением комплементарности естественных нуклеотидов.
Стивен Беннер впервые получил искусственные нуклеотиды во второй половине 1980-х, а Флойд Ромсберг в 2014 году смог внедрить парные искусственные основания в живую клетку. Эти исследования, а также сопутствующий вклад Эрика Кула, заслуживают более подробного рассмотрения, и я о них расскажу ниже.
Кубок конструкторов
В 1986 году Беннер возглавил биохимическую лабораторию в Высшей технологической школе Цюриха (ETHZ) и взялся перестраивать каркас ДНК, состоящий из двух спиралей. В состав этого каркаса входят фосфаты, имеющие отрицательный заряд, а также сахара. Таким образом, участки каркаса взаимно отталкиваются, и это позволяет сохранять между ними просвет, внутри которого протянута лесенка нуклеотидов. Беннер пытался заменять отрицательные группы на нейтральные, но такая цепочка сохраняла стабильность лишь на очень небольших отрезках. Как только в ней накапливалось около 10 пар оснований, она свёртывалась в кольцо. Таким образом, для искусственного наращивания ДНК новыми основаниями или искусственного создания подобных молекул требуется:
1) Добавлять основания попарно, чтобы они были комплементарны друг другу, а не вступали в пару с естественными основаниями
2) Обеспечить достаточную гидрофобность каркаса молекулы, чтобы между двумя спиралями сохранялся просвет, но при этом и достаточную гидрофильность самих оснований, чтобы между ними могли возникать связи водород-водород, а РНК могла надёжно копировать информацию, также через гидрофильное взаимодействие.
На первом этапе работы (в конце 1980-х) группа Беннера синтезировала первую пару искусственных нуклеотидов – изогуанин и изоцитозин, являющихся, соответственно, изомерами (топологическими вариантами) гуанина и цитозина и комплементарных друг другу.
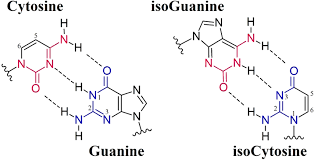
Оказалось, что ферменты-полимеразы, копирующие ДНК и транскрибирующие её в РНК, исправно читают двойную спираль, содержащую искусственные основания и добавляют такую комплементарную пару в наращиваемую нить нуклеиновой кислоты. В свою очередь, рибосомы — клеточные органеллы, отвечающие за трансляцию РНК в белок — считывают изоцитозин и добавляют в растущий белок синтетическую аминокислоту. Но в этой паре мы работаем с изомерами, а это оказалось сопряжено с дополнительными рисками: в растворе крайний водород в изогуанине может спонтанно менять положение, и из-за этого изогуанин становится комплементарен не изоцитозину, а тимину, вступает с ним в связь. ДНК становится нерабочей.
Вскоре после Беннера аналогичными исследованиями занялся биохимик Эрик Кул из Стэнфордского университета. Он приступил к разработке дизайнерской ДНК в середине 1990-х. Кула интересовало не столько сходство искусственных нуклеотидов с естественными, сколько стабильность водородных связей. Первым большим успехом Кула был синтез основания F – дифтортолуола. Этот нуклеотид был практически идентичен по форме тимину, но на месте атомов кислорода в нём стояли атомы фтора. В такой конфигурации атомы водорода прочно оставались на своих местах и не образовывали непредусмотренных связей.
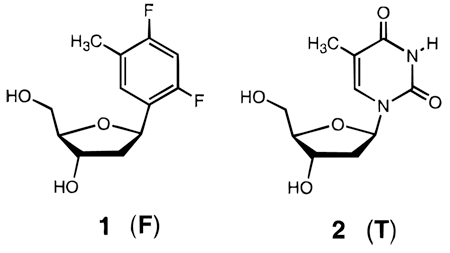
Практика показала, что сам фтор в такой конфигурации очень плохо связывается с водородом, но полимеразы всё равно обращаются с незнакомым нуклеотидом как с тимином: ставят его в пару с аденином, либо, наоборот, прикрепляют к нему аденин. Кул заключил, что в формировании пар важна не только химическая, но и геометрическая составляющая. Основания соединяются по принципу «ключ-замок».
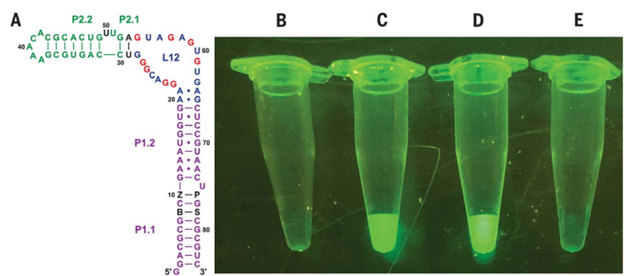
Впоследствии группа Беннера провела серию экспериментов, показавших, что молекула ДНК с искусственными основаниями сохраняет не только форму, но и информационную функцию. Нуклеотиды связываются в предсказуемом порядке, нормально поддаются репликации, умеренно мутируют. Важнее всего, что синтетическая ДНК нормально транскрибируется в РНК. Для демонстрации этой способности Беннер с коллегами синтезировали участок синтетической ДНК, которая кодирует аптамер. Аптамер — это последовательность, которая не служит шаблоном-трафаретом для белка, а связывается с конкретными молекулами и активирует их, заставляя проявлять характерные свойства. Аптамер Беннера активировал флуоресцентную молекулу, и его срабатывание в растворе сразу было заметно:
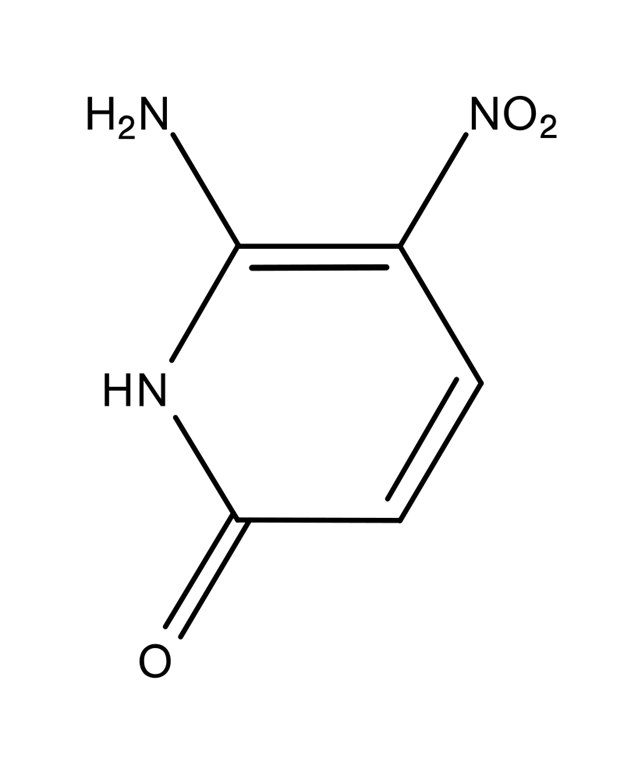
Далее с течение 2010-х годов Беннер с коллегами разрабатывали новые пары нуклеотидов, которые более или менее удачно встраивались в ДНК. Однако есть причины полагать, что ДНК может включать и 10, и 12 оснований («букв»). В феврале 2019 года Беннер получил ныне уже знаменитую хатимодзи-ДНК. «Хатимодзи» в переводе с японского означает «восемь букв». Наряду с естественными А, G, C и Т в хатимодзи-ДНК входят изогуанин (B), изоцитозин (rS) а также ещё одна пара, которую Беннер обозначил «dS» (1-метилцитозин)
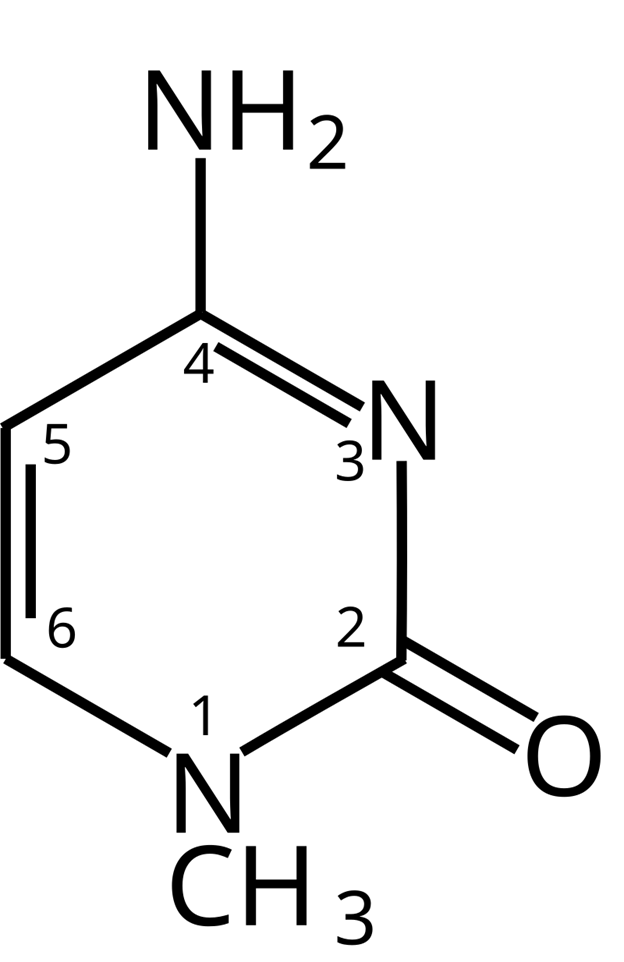
и «Z» (6-амино-5-нитропиридин-2-ol).
Вот как выглядит хатимодзи-ДНК в 3D
Чуть позже Эрика Кула к исследованию искусственных нуклеотидов подключился Флойд Ромсберг, который интересовался в первую очередь расширением набора гидрофобных оснований. За основу он взял простейшие органические соединения, содержащие двойные связи — бензол и нафталин. Далее, по словам Ромсберга, они с коллегами принялись синтезировать «любые мыслимые производные», многие из которых на первый взгляд вообще не походили на основания ДНК. Именно в процессе этого поиска Ромсберг заметил, что в потенциальных основаниях для ДНК должны деликатно сочетаться гидрофильность и гидрофобность, о чём я писал выше. Основание должно быть достаточно гидрофобным, чтобы ферменты могли вставить его в ДНК, но при этом и умеренно гидрофильным, чтобы принимать водородные связи. Последний аспект необходим для успешного копирования информации.
В течение 2000-х Ромсберг успел проверить около 3600 соединений и выбрать из них десятки кандидатов на роль нуклеотидов. Эти исследования вписались в более широкий контекст конструирования лекарств. Дополнительно опираясь на знания о взаимосвязях «структура-активность», Ромсберг разработал набор новых оснований, стараясь как можно сильнее сократить их гидрофобную поверхность. В числе таких пар он отдельно упоминает dTPT3–dNaM, которая ничуть не уступает естественным нуклеотидам в скорости и точности репликации.
В настоящее время конструирование искусственных оснований для ДНК постепенно переходит из качества в количество, а различные исследовательские группы (в первую очередь, Ромсберг) добиваются первых положительных результатов по выживаемости биологических клеток, в которые внедрена частично искусственная ДНК. Стивен Беннер руководит Фондом прикладной молекулярной эволюции во Флориде, Эрик Кул продолжает исследования по синтезу чужеродных нуклеиновых кислот (XNA) в Стэнфорде, Флойд Ромсберг сосредоточен на разработке таких нуклеотидов, репликация которых была бы применима не только в генетических целях, но и для ускоренного размножения ДНК (амплификации) и превращения этой молекулы в органическое хранилище данных. Наряду с ними синтезом новых нуклеотидов занимается группа под руководством Ичиро Хирао из японского центра RIKEN по системной и структурной биологии. Таким образом, возможность расширения генетического алфавита многократно независимо доказана. Остаётся поговорить о том, каковы могут быть обозримые последствия таких вмешательств. Для начала давайте обсудим, почему ДНК лишь по форме является кислотой, а по сути — информационной молекулой.
Информационная молекула
Основное назначение нуклеиновых кислот — это хранение информации. Последовательности букв-нуклеотидов складываются в чертежи для конструирования белков. Естественный набор из четырёх нуклеотидов кодирует 20 аминокислот, на основе которых кодируются миллионы белков. Белки земных организмов бывают настолько несовместимы, что именно на белковой основе строятся смертоносные несинтетические яды. Учитывая вышеизложенное, возникает вопрос: почему земная биохимия ограничилась пятью азотистыми основаниями? Напомню, что в состав ДНК входят аденин, цитозин, гуанин и тимин, а в РНК на месте тимина используется схожее азотистое основание урацил.
Информатика подсказывает, что носитель информации действительно должен быть парным, то есть, представлять собой последовательность, состоящую, как минимум, из комбинаций 0 и 1. Естественный алфавит ДНК — четырёхбуквенный, но природа не породила никаких более широких комбинаций, например, хатимодзи-ДНК. По мнению Раманараяна Кришнамурти, работающего в исследовательском центре Скриппса вместе с Ромсбергом, двухбуквенный алфавит потребовал бы выстраивать более длинные цепочки ДНК, которые бы занимали в клетке больше места и быстрее рвались, тогда как при увеличении генетического алфавита сверх 4 букв возросло бы количество ошибок при копировании. Вероятно, эволюция не поддержала не только увеличения количества нуклеотидов сверх 4, но и включение фтора в биохимические молекулы из-за чрезмерной агрессивности и достаточной редкости этого элемента.
С другой стороны, при контролируемом развитии увеличенного алфавита и искусственном культивировании клеточных культур, включающих новые нуклеотиды, достоинства такого подхода могут перевесить его недостатки. Очевидно, что расширенный алфавит ДНК располагает к синтезу более разнообразных белков, что позволило бы улучшенным организмам заселять ранее недоступные экологические ниши и открыло бы доступ к новым источникам энергии. Кроме того, в ДНК можно было бы включать такие основания, которые катализировали бы уже известные биохимические реакции и позволяли, например, дышать при сниженном количестве кислорода в атмосфере.
Искусственная ДНК также могла бы содержать инструкции и признаки, не встречающиеся в живой природе. Уже сейчас, оперируя четырьмя естественными основаниями, парфюмеры создают новые ароматы, а биохимики научились синтезировать фермент, расщепляющий глютен и помогающий лечить целиакию.
Среди наиболее амбициозных целей, которые ставит перед собой преимущественно Стивен Беннер — создание пар оснований, которые бы превосходили естественные аналоги при селективной привязке к некоторым клеткам, например, к раковым. Уже доказано, что при наличии оснований P и Z такая способность противоракового препарата повышается.
Кроме того, Беннер надеется откатить биохимию на такой примитивный уровень, где она предположительно могла обходиться без ферментов. В такой ситуации ДНК могла бы служить долговременным хранилищем информации (storage), тем более, если бы это была расширенная ДНК, а перенос информации и каталитические функции полностью брала бы на себя расширенная РНК, для которой можно было бы придумать новые разновидности, наряду с современными матричным, транспортным и рибосомальным вариантами. В более широком контексте те исследования, что описаны в этой статье, могут послужить для нас предварительной подготовкой к встрече с внеземной жизнью. Они уже сейчас подводят нас к пониманию, что земная ДНК в принципе может уступать синтетическим формам в скорости распространения и информационной ёмкости, а значит — и в разнообразии генетического и белкового материала. Будем следить, к чему приведут опыты по размножению искусственных нуклеотидов в бактериальных культурах.
Автор: OlegSivchenko






