Посвящается всем отчаявшимся и потерявшим надежду… открутить заржавевшую гайку!
На улицы наших городов определенно пришла весна. Потеплело и люди с радостью начали отдавать предпочтение своим настоящим железным друзьям, хоть на время забывая про планшеты и смартфоны. Велосипедисты, мотоциклисты и еще множество любителей сезонных средств передвижения достали свое добро и вдруг обнаружили, что что-то заржавело, что-то невозможно открутить и т.д. и т.п. Признаюсь, я один из этих, обнаруживших :) И чтобы не пропал даром труд по борьбе с коррозией, решил накопленный материал оформить в хабра-статью.
Информация точно будет полезна абсолютно всем, кому хотя бы раз приходилось бороться с ржавыми деталями, не только автолюбителям и самодельщикам, но и реставраторам техники, тем кто собирается красить ржавые столбы на даче/страдает от ржавых разводов на раковине и просто желающим докопаться до сути процесса ржавления и найти методы эффективной борьбы с этой напастью. Сегодня говорим о том, как разбудить «заснувшую сталь».
Ну и, традиционно — не забудь закинуть в закладки, %USERNAME%, пригодится! :)

Химический background
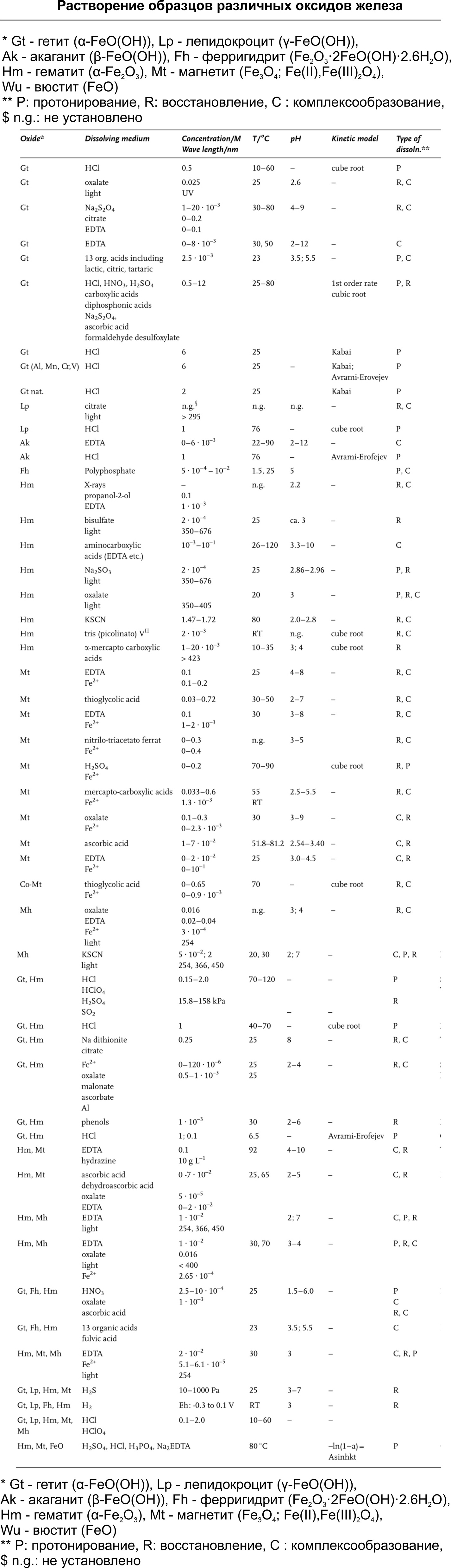
Мы живем в мире железа и его сплавов. А там где есть железо — там обязательно будут и его оксиды в виде ржавчины. Любой железный элемент будет ржаветь на открытом воздухе, вопрос только в том, насколько быстро. При воздействии содержащихся в воздухе воды, кислорода, агрессивных газов черные металлы легко переходят в химически стойкие формы их соединений. Этот естественный процесс перехода неметаллов в оксиды, гидроксиды и соли начинается с поверхности, поэтому незащищенная поверхность черных металлов всегда покрыта пленкой продуктов коррозии. Толщина этих пленок зависит от условий образоваобразования и колеблется от долей микрометра до нескольких миллиметров. Процесс коррозии развивается со временем даже при благоприятных условиях хранения, так как многие соли гигроскопичны, а рыхлые оксидные и гидроксидные образования сорбируют и удерживают воду из воздуха, что способствует развитию процесса коррозии.
По сути, ржавление металла — это просто окисление железа кислородом воздуха, в котором вода выступает в роли катализатора. Описывается все это тремя основными реакциями:
O2+4e-+2H2O → 4ОН-
Fe → Fe2++2е-
4Fe2++O2 → 4Fe3++2O2-
Железо являясь достаточно активным металлом, отдает электроны и окисляется, вода эти электроны принимает и подщелачивает OH- ионами реакционную среду. Ионы двухвалентного железа в комбинации с OH- выпадают в нерастворимый осадок гидроксида железа (II), который постепенно в присутствии все того же кислорода начинает формировать различные комбинации из оксидов/гидроксидов, в том числе и из-за процессов ступенчатой дегидратации.
Fe2+ + 2H2O ⇌ Fe(OH)2 + 2H+
Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+
Fe(OH)2 ⇌ FeO + H2O
Fe(OH)3 ⇌ FeO(OH) + H2O
2FeO(OH) ⇌ Fe2O3 + H2O
Состав ржавчины, соответственно, медленно меняется со временем, в зависимости от условий окружающей атмосферы (избыток/недостаток кислорода и воды)
Как уже говорилось, состав образующейся ржавчины может варьироваться в зависимости от типа стали, наличия электролитов, агрессивности воздействия и его продолжительности. В целом считается, что существует 16 оксидов железа, имеющих различную кристаллическую структуру, химический состав и валентное состояние железа, которые теоретически можно найти в ржавчине. В наших краях чаще всего ржавчина образовавшаяся при комнатной температуре может содержать гетит (α-FeO(OH)), акаганит (β-FeO(OH)), лепидокроцит (γ-FeO(OH)) и магнетит (Fe3O4;Fe(II),Fe(III)2O4). Рекомендую запомнить эти названия, они еще пригодятся. Большинство исследователей сходятся в том, что основным кристаллическим компонентом ржавчины является γ-FeO(OH), при подогреве переходящий в γ-Fe2O3. Если деталь или изделие ржавеет длительное время во влажной атмосфере, в ржавчине можно обнаружить небольшие количества Fe3O4 (часто нестехиометрического состава). Образцы ржавеющие в дистиллированной воде — это ржавчина из кристаллического α-FeO(OH), γ -FeO(OH) и Fe3O4. Если металл подвергается ржавлению в камере солевого тумана, то основным кристаллическим компонентом ржавчины является γ-FeO(OH) с пластинчатой и пористой структурой.
Хотелось бы еще напомнить о том, что соли, в частности хлорид-ионы выступают в роли своеобразного электрохимического катализатора, ускоряющего коррозию (наши зимние дороги и днища автомобилей не дадут соврать) и способствующего образованию γ-FeO(OH). Существуют исследования, в которых авторы сравнивают ржавчину взятую на анализ в различных местностях (приморские, континентальные и т.п.). Ржавчина, образовавшаяся в прибрежных районах, была в основном в виде крупных чешуек, в областях с высокой влажностью и хлоридами в почвах формировалась ржавчина в виде листов, порошкообразная и мелкозернистая ржавчина — удел центральных и северных территорий. Образцы слоистой ржавчины содержали γ-Fe2O3·H2O на поверхности контакта с воздухом и Fe3O4 на поверхности контакта с металлом, α-FeOOH и δ-FeOOH были обнаружены в промежуточных слоях и в хлопьях.
Зачем я все это рассказываю, а затем, что врага надо знать в лицо. Чем точнее определить тип ржавчины — тем эффективнее можно ее растворить.
Хорошо известно, что в зависимости от условий окружающей среды может образовываться разноцветная ржавчина: красная ржавчина (гидратированный оксид Fe2O3·H2O образуется при высоком уровнях кислорода и водяных паров, чаще всего это равномерная атмосферная коррозия в очень агрессивных средах.), желтая ржавчина (т.н. сольватированная ржавчина, растворимый FeO (OH)·H2O образуется в условиях высокой влажности, чаще всего, если металл находился с луже/стоячей воде), бурая ржавчина (сухой оксид Fe2O3, который образуется при высоком содержании кислорода и низкой влажности, чаще представляет собой локализованную ржавчину, которая проявляется в виде неоднородных пятен или только в определенных областях (загрязнения и дефекты на поверхности металла) и черная ржавчина (оксид Fe3O4 который образуется в среде с низким содержанием кислорода и низкой влажности, является устойчивым видом ржавчины, похожим на слой покрытия, возникающего при оксидировании металла).

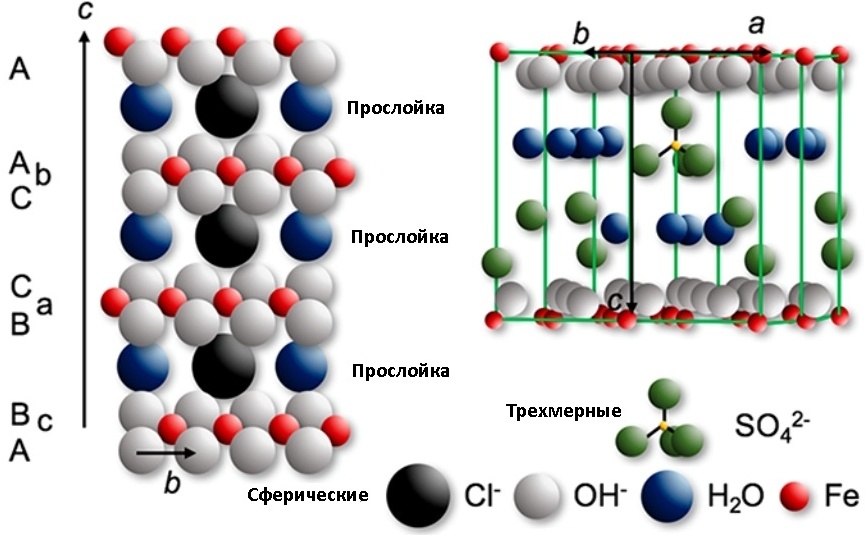
Если в дело вступают ионы различных неорганических кислот (карбонаты, сульфаты, упомянутые уже хлориды, а также бромиды, фториды, иодиды, нитраты и селенаты) то может образовываться т.н. зеленая ржавчина

Зеленая ржавчина — это общее название для различных кристаллических соединений зеленого цвета, содержащих катионы железа и упомянутые выше анионы. Образуется эта красота (?) на поверхностях из железа/чугуна/стали подвергнувшихся воздействию воды, содержащей хлорид, сульфат, карбонат или бикарбонат-ионы при чередовании аэробных/анаэробных условий. Например, в морских судах, мостах и т.п. Общий вид кристаллической структуры зеленой ржавчины представлен на картинке. В принципе, можно считать, что структура обычной «оттенков красного» ржавчины во многом похожа на зеленую, но без кислотных анионов.
Хотя ржавление в целом является отрицательным аспектом, есть примеры, когда и оно служит человеку. В качестве примера можно привести воронение стволов оружия (в т.ч. обработка так называемым «ржавым лаком»). На металле формируется тонкая оксидная пленка «черной ржавчины» (описанной выше), предохраняя металл от дальнейшего окисления. Этот процесс еще называют оксидирование:
Оксидирование — создание оксидной плёнки на поверхности изделия или заготовки в результате окислительно-восстановительной реакции. Оксидирование преимущественно используют для получения защитных и декоративных покрытий, а также для формирования диэлектрических слоёв.
В качестве примера можно упомянуть железную колонну (она же Кутубова колонна) в Дели — цилиндр высотой семь метров и весом в шесть с половиной тонн, входящий в состав архитектурного ансамбля Кутб-Минара, расположенного примерно в 20 километрах южнее Старого Дели. Известность колонна приобрела тем, что за 1600 лет своего существования практически избежала коррозии.

Чего там только по поводу этой колонны не предполагали, от «сделано из метеоритного железа» до «подарок Шивы». Но, традиционно, ответ оказался прост — «высокая температура и сухой воздух» спасут отца русской демократии. Тонкая оксидная пленка замечательно защищает металл от ржавчины, если на него воздействуют лишь пресная вода или сухой воздух.
Резьбовая ржавчина as is
Если кратко представить механизм ржавления резьбы, то получится что он практически не отличается от ржавления металла на поверхности. Первоначально в межрезьбовые каналы (между гайкой и болтом) попадает вода, которая в сочетании с кислородом воздуха и электронами железа запускает процессы, описанные формулами выше. В результате этого процесса начинают формироваться оксиды и гидроксиды железа, которые в зависимости от условий претерпевают циклы гидратации/дегидратации и формируют монолитную пористую структуру. Можно сказать, что ржавление внутри резьбы отличается от ржавления открытого металла тем, что внутри резьбы может наблюдаться недостаток кислорода и будет формироваться что-то подобное на черную ржавчину (Fe3O4).
Наверное самым близким к «закисанию резьбы» явлением является ржавление железобетона. Те же условия с недостатком кислорода. В таких условиях образующийся в результате окисления объем рыхлых оксидов значительно больше, чем объем прореагировавшего металла. Оксиды полностью заполняют все поры и неплотности (резьбы или выступов около арматуры), выступая в качестве своеобразной расклинивающей подпорки или уплотнителя.
В результате описанного процесса, медленно но неумолимо верно, ржавчина давит на все с ней контактирующее и разрушает бетон, блокирует резьбу и т.п. Существует даже такое явление как «rust packing» или «pack rust», что в переводе на великий и могучий означает «пакетная ржавчина». Наблюдается оно в тех случаях, когда объем образовавшихся оксидов своим расклинивающим давление выдавливает соседствующие с местами коррозии детали металлоконструкций. Самым известным примером воздействия пакетной ржавчины может стать обрушения моста через реку Мианус в США в 1983 году с множеством жертв.

Специальное расследование установило, что коррозия, возникшая в результате попадания дождевой воды на элементы металлоконструкций моста из-за нарушенных технологий дренажа, постепенно просачивалась к креплениям из железа. Крепления постепенно ржавели и по миллиметру отталкивали один угол дорожной плиты от опоры. Когда расстояние стало достаточным для разрушения — один проехавший автомобиль послужил спусковым крючком. С тех пор в мостостроении появился новый термин и активно используется, когда при осмотре моста наблюдаются признаки накопления ржавчины между стальными пластинами и соединениями моста

Надеюсь механика процесса примерно понятна. Она нужна для того, чтобы оценить существующие методы борьбы с резбовой (почти «пакетной») ржавчиной.
Методы разрушения ржавчины внутри резьбы
В простейшем рассмотрении для того, чтобы открутить болт нужно сделать две вещи
- Разрушить (=диспергировать) монолитную пористую массу оксидов и гидроксидов с образованием областей пониженной плотности, «дефектов» и полостей
- Снизить трение между обломками монолитных оксидов и позволить им легко скользить друг относительно друга вместе с проворачиванием гайки
Сделать это можно различными методами:
разрушение_метод 1 — Механический
Фактически, дедовский. Потому что с давних пор, при отсутствии других возможностей, по заржавевшей резьбе принято стучать в надежде разрушить вибрацией монолитные пластины и цепочки образовавшихся оксидов. Как только болт стронется, оксиды (а вещества они достаточно хрупкие) дальше будут сами перетираться в пыль. Метод не особо эффективный и кроме того требующий специалиста «чувствующего молоток», чтобы ненароком не свернуть или не заклепать намертво болт.
Неплохим вариантом является использование электрических или пневматических ударный гайковертов, вроде того, что на картинке:

Хотя в этом случае также как и с обычным молотком главное не переборщить и не сломать болт. Правильно подобранную головку лучше устанавливать со стороны гайки, а сам болт при этом поддерживать дополнительно гаечным ключом.
В случае, если нет необходимости спасать крепеж (например, в случае антикварных автомобилей) можно просто срезать гайку углошлифовальной машиной (болгаркой), а болт высверлить. Но трудозатраты на такую процедуры таковы, что я бы посоветовал использовать этот метод в последнюю очередь, опробовав все описанные в статье возможности.
разрушение_метод 2 — Термический
Данный метод основан на понимании того, что все тела при нагревании расширяются, а при охлаждении — сжимаются. Нагрев гайки (или объекта в который ввёрнут болт), будет приводить к образованию микроразрывов в оксидном монолите расположенном вдоль резьбы. Чередование циклов нагрев/охлаждение весьма вероятно приведет к раздроблению хлопьев ржавчины и образованию «разряжения». А как только внутри слоя образовались прорехи — болт скорее всего провернётся. Помимо механического раздавливания оксидных слоев из-за расширения металла, имеет место и дегидратация самых компонентов ржавчины. Например, отжиг при 350 °C превращает ржавчину в основном в маггемит (γ-Fe2O3), при 550 °C образуется магнетит, и при 750 °C ржавчина превращается в смесь магнетита, вюстита (FeO) и металлического железа (Fe).

Ранее данный метод был доступен только владельцам ацетиленовых или пропановых горелок, но с появлением aliexpress сегодня практически каждый может приобрести компактную горелку на «дихлофосный» баллон и прокаливать заржавевшие болты и гайки в свое удовольствие.

Активно термическое удаление ржавчины используется и в реставрации железных изделий. Правда это не просто отжиг, а высокотемпературное восстановление оксидов в элементарное железо. Делается это либо с помощью нагревания заржавевших изделий в среде оксида углерода (он же CO, он же угарный газ) под слоем древесного угля при ограниченном доступе воздуха и температуре 800 °С. Может использоваться и водород в качестве восстановителя, особенно если есть доступ к трубчатым печам с регулируемой по длине печи температурой. В реакционную часть печи подается аммиак, который на катализаторе при 400-600 °С разлагается на азот и водород. Водород восстанавливает оксиды до «губчатого железа», которое в дальнейшем требует дополнительной обработки защитными средствами, вроде расплавленного парафина.
разрушение_метод 3 — Химический
Химический метод разрушения резьбовой ржавчины основан на том, что химические компоненты, попадая в поры и капилляры оксидного слоя могут вступать с ним во взаимодействие, либо переводя ржавчину в растворимое соединение, либо восстанавливая до металлического железа. И то и другое снимает расклинивающее давление внутри резьбы и позволяет провернуть гайку за счет образующихся дополнительных пор или участков пониженной плотности. В целом, механизмы воздействия химического метода можно разделить на три направления: протонирование, комплексообразование, восстановление. Недаром я в начале статьи привел названия самых распространенных «минералов» формирующих ржавчину. Сделал я это для того, чтобы пытливый читатель мог подобрать себе подходящий реагент, спрятанный в таблице под спойлером.
А теперь, немного подробностей, по поводу каждого из механизмов с примерами.
Протонирование
В результате протонирования в реакцию с ржавчиной вступают реагенты, способные стать донором протонов (H+). Чаще всего для этой цели используются минеральные неорганические кислоты.
Традиционно для очистки поверхности железа от продуктов коррозии применяют растворы минеральных кислот. Наиболее активным является раствор, содержащий 35 % ортофосфорной и 5-10% соляной кислоты. Растворы кислот — серной, соляной — позволяют достаточно быстро удалить продукты коррозии, но всегда вызывают некоторое растравливание металла. Для предотвращения этого в растворы кислот вводят ингибиторы коррозии. Так, в 1 М раствор серной кислоты целесообразно добавлять тиосемикарбазид, тиомочевину, уротропин, трифенилфосфин, бензотриазол (хорошие результаты достигаются при обработке железа 1М раствором серной кислоты, содержащим 0,1—0,5 % тиомочевины или 0,5—1,0% бензотриазола); в 1 М раствор соляной кислоты — уротропин и трифенилфосфин.
На заметку: Трифенилфосфин — органическое соединение с формулой P(C6H5)3, или просто Ph3P. Является производным фосфина. Имеет вид белых кристаллов. Относительно стабилен при хранении на воздухе.
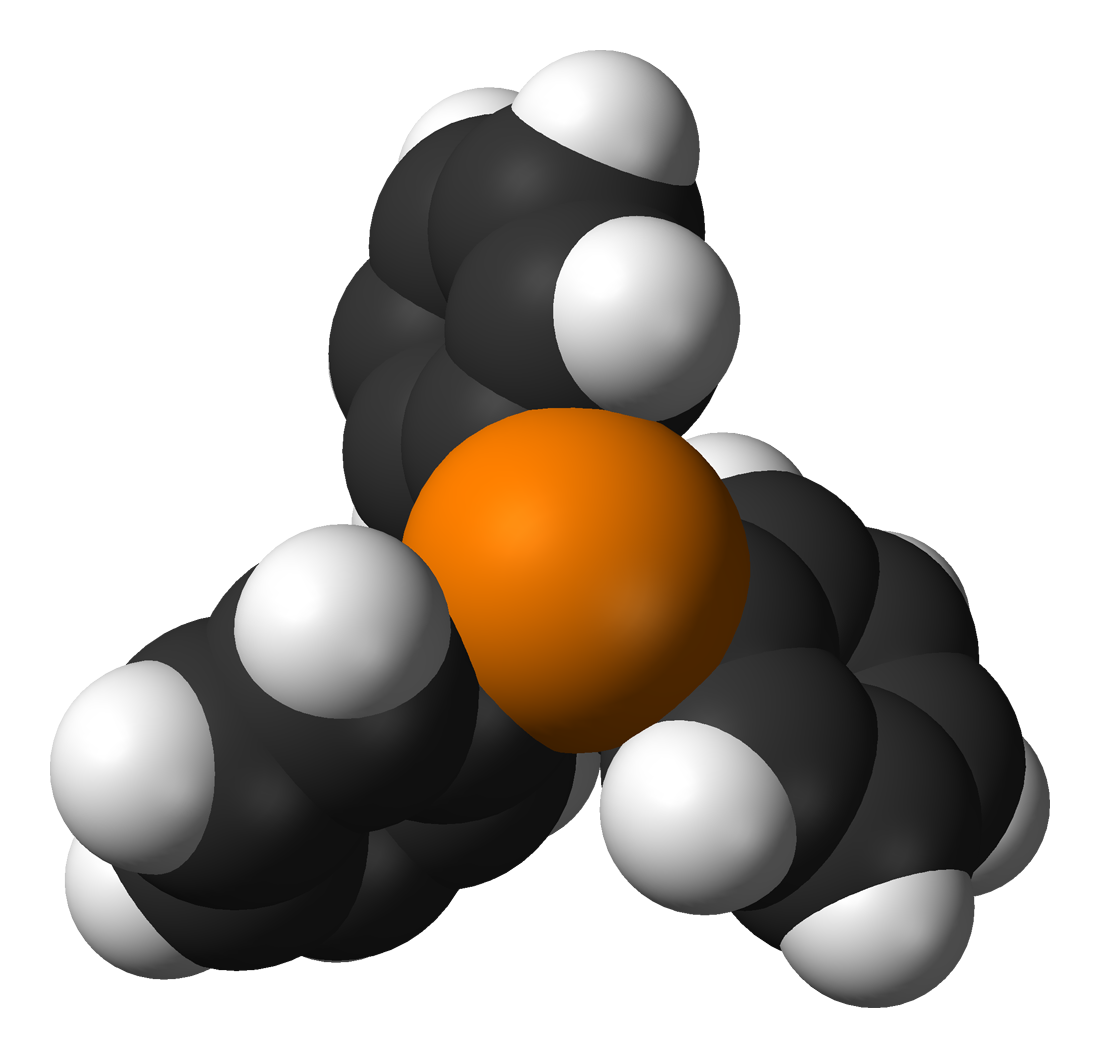
Трифенилфосфин интересен еще и тем, что его производное, оксид трифенилфосфина широко используется в микроэлектронике, и по его запаху собак породы лабрадор в США учат находить различные устройства электронной памяти. Под спойлером выдержка из «Наука и жизнь» №10/2018

Тренировка ищеек на поиск электроники занимает полгода. Предварительно криминалисты провели исследования — чем могут пахнуть устройства компьютерной памяти? Оказалось, что все они содержат окись трифенилфосфина, вещества, которое используется в производстве наноэлектроники. Для человека этот белый порошок не имеет никакого запаха, но четвероногие сыщики его чувствуют. Собак приучают ассоциировать этот запах с кормёжкой, и вплоть до «выхода на пенсию» их кормят только по результатам поиска. Впрочем, раз в неделю пёсикам дают отдохнуть и кормят просто так, без поисков.
Программу обучения и использования «сыщиков электроники» два года держали в тайне, опасаясь, что преступники найдут какой-то способ маскировки запаха или противодействия собачьему нюху, но недавно эти сведения рассекретили. Выяснилось, что не помогает даже спрятать микросхему в баллончик с кремом для бритья, имеющим свой чётко выраженный запах.
Раз уж пошел разговор за ингибиторы, то помимо упомянутых выше (и имеющихся в таблицах ASTM ниже по тексту) можно еще упомянуть и различные амины, встречающиеся в брендовых «растворителях ржавчины». Активно используются моноэтиламин, диэтиламин, триэтиламин и т.п. (что под рукой есть).
Комплексообразование
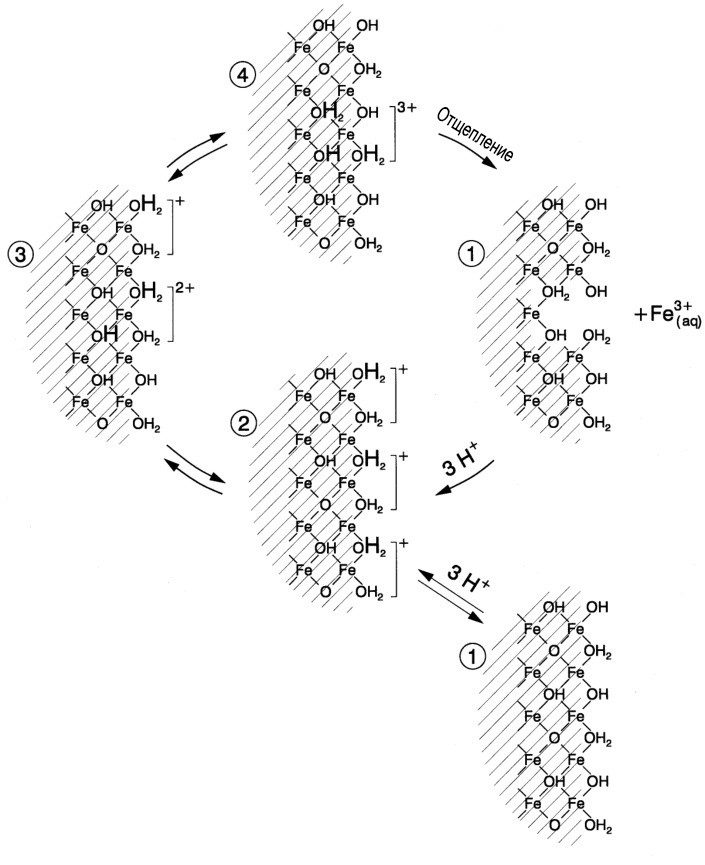
Комплексообразование — процесс возникновения т.н. координационных соединений. Они представляют собой нейтральные молекулы или ионы, возникшие в результате присоединения к иону или атому, называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Чаще всего в роли лигандов выступают объемные органические молекулы.
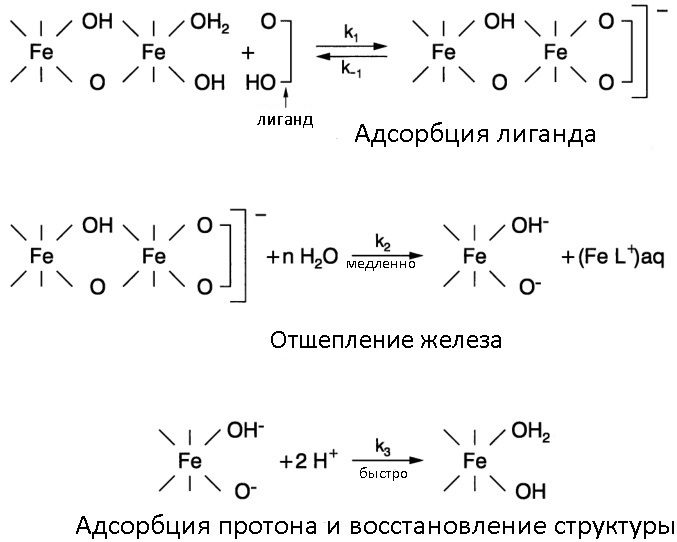
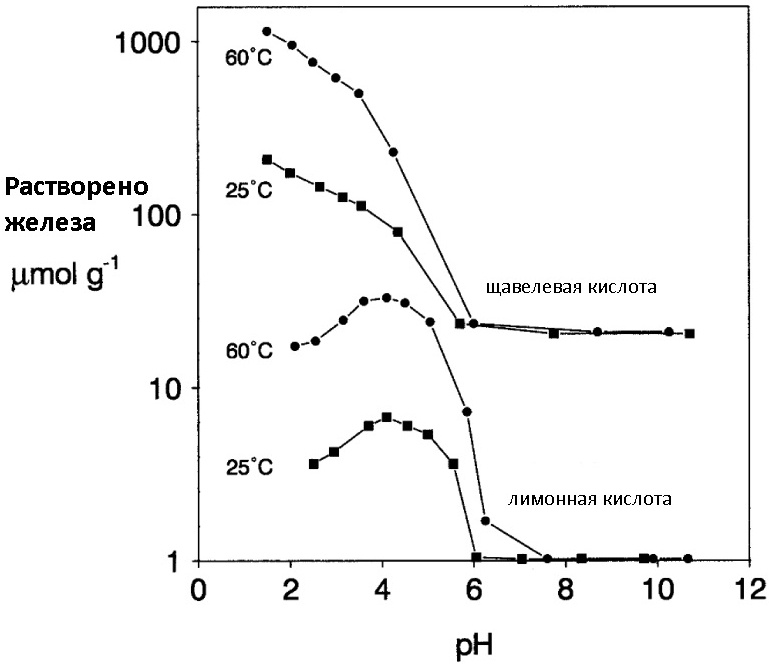
Большая часть используемых в растворении ржавчины органических кислот — работают именно по механизму образования комплекса с ионами Fe (III). Наилучшую эффективность показывают муравьиная, лимонная и щавелевая кислота (а также их соли), этилендиаминтетрауксусная кислота (EDTA) и ее соль Трилон-Б, активно используемая во всевозможных Calgon-ах для удаления накипи. При использовании растворов органических кислот допускается введение в их состав ингибиторов коррозии (того же уротропина), так как кислоты пусть и медленно, но все-таки иногда вызывают растравливание металла. Хотелось бы отметить, что органические кислоты лучше работают в кислой среде и при нагревании (см. картинку под спойлером).
Восстановление
Ну и наконец, третий механизм, с помощью которого структурные связи между атомами железа в оксидах железа могут быть ослаблены и разрушены, представляет из себя восстановление структурного Fe (III) до Fe (II) (а то и Fe0, если повезет). Суть его заключается в процессах переноса электронов и связанной с этим адсорбцией донора электронов, катодной поляризацией электрода, переноса электрона из неустойчивых поверхностных комплекса на поверхность Fe (III) и еще много матана. Более важно, на мой взгляд, то что в качестве восстановителей используют огромное количество соединений — дитионит (бисульфит) натрия, тиогликолевую (она же меркаптоуксусная, широко применяемую при химической завивке и окрашивании волос) кислоту, тиоцианат, гидразин, аскорбиновую кислоту, гидрохинон, сероводород, фруктозу, сахарозу. И даже такие удивительные вещи, как фульфокислоты из почвы:
При соответствующих условиях восстановительное растворение также может осуществляться фотохимически.
Наиболее популярными восстановителями является перекись водорода, 3—5%-й водный растворе NaOH и сульфита натрия Na2SO3, уже упомянутый выше бисульфит натрия, аскорбиновая кислота. Часто в качестве восстановительного растворителя ржавчины используют порошка цинка в 15%-м растворе NaOH (который, кстати, при нанесении на гладкие ржавые поверхности, дополнительно загущают поливиниловым спиртом)
Сравнение эффективности различных методов растворения ржавчины
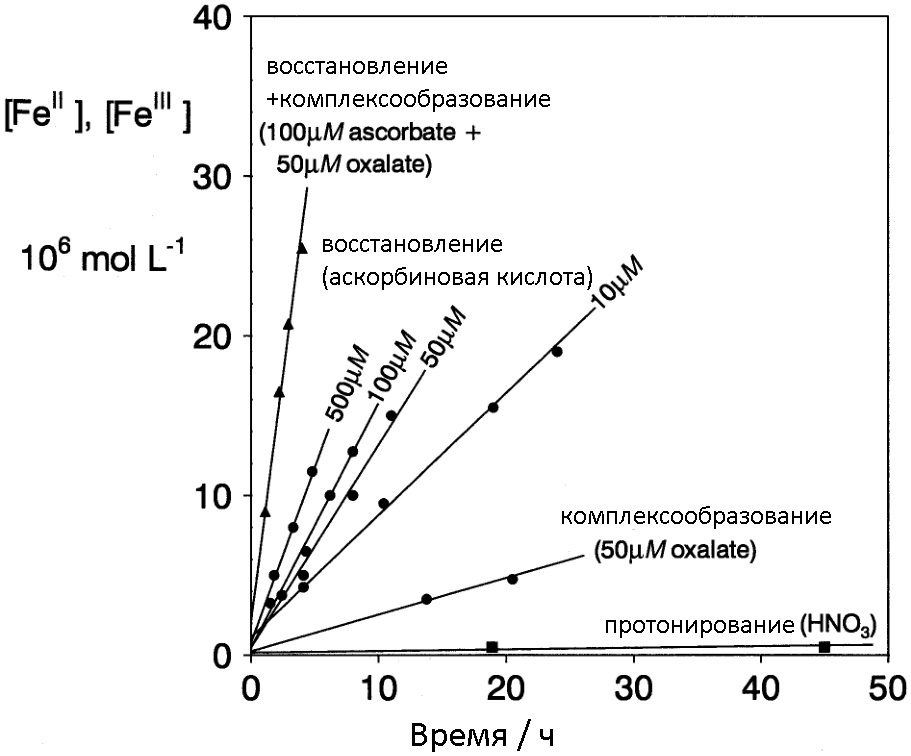
Часто для растворения ржавчины используют не индивидуальные реагенты, а их комбинации, где каждое вещество реализует свой механизм растворения оксидов железа. В качестве примера может служить тот же цинк+NaOH в который для ускорения процесса добавляют трилон Б, регулируя тем самым очищающую способность смеси. Под спойлером представлена картинка, с помощью которой можно сравнить скорость растворения ржавчины с использованием различных механизмов.
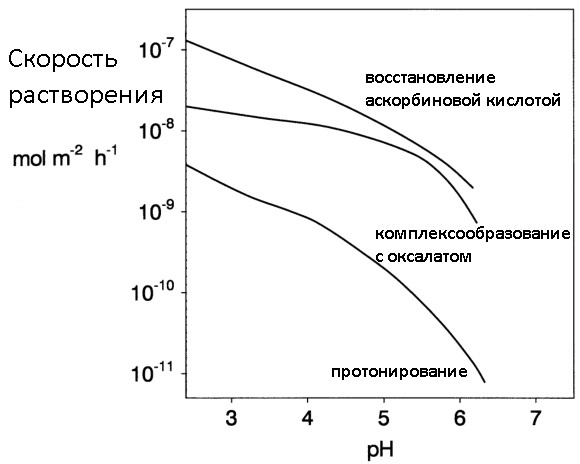
Ниже представлена диаграмма, на которой видно, что наибольшей эффективностью обладают методы растворения ржавчины с использованием комбинаций различных (разнотипных) «разрушителей оксидного слоя».
Ну и подытоживая, приведу методическую рекомендацию, взятую из американского стандарта ASTM посвященную удалению продуктов коррозии с металла. Сами американцы, я так понимаю, акцент делали скорее всего на обработке материалов на плоскости, но все ниже озвученное запросто можно применить и к резьбовым соединениям.
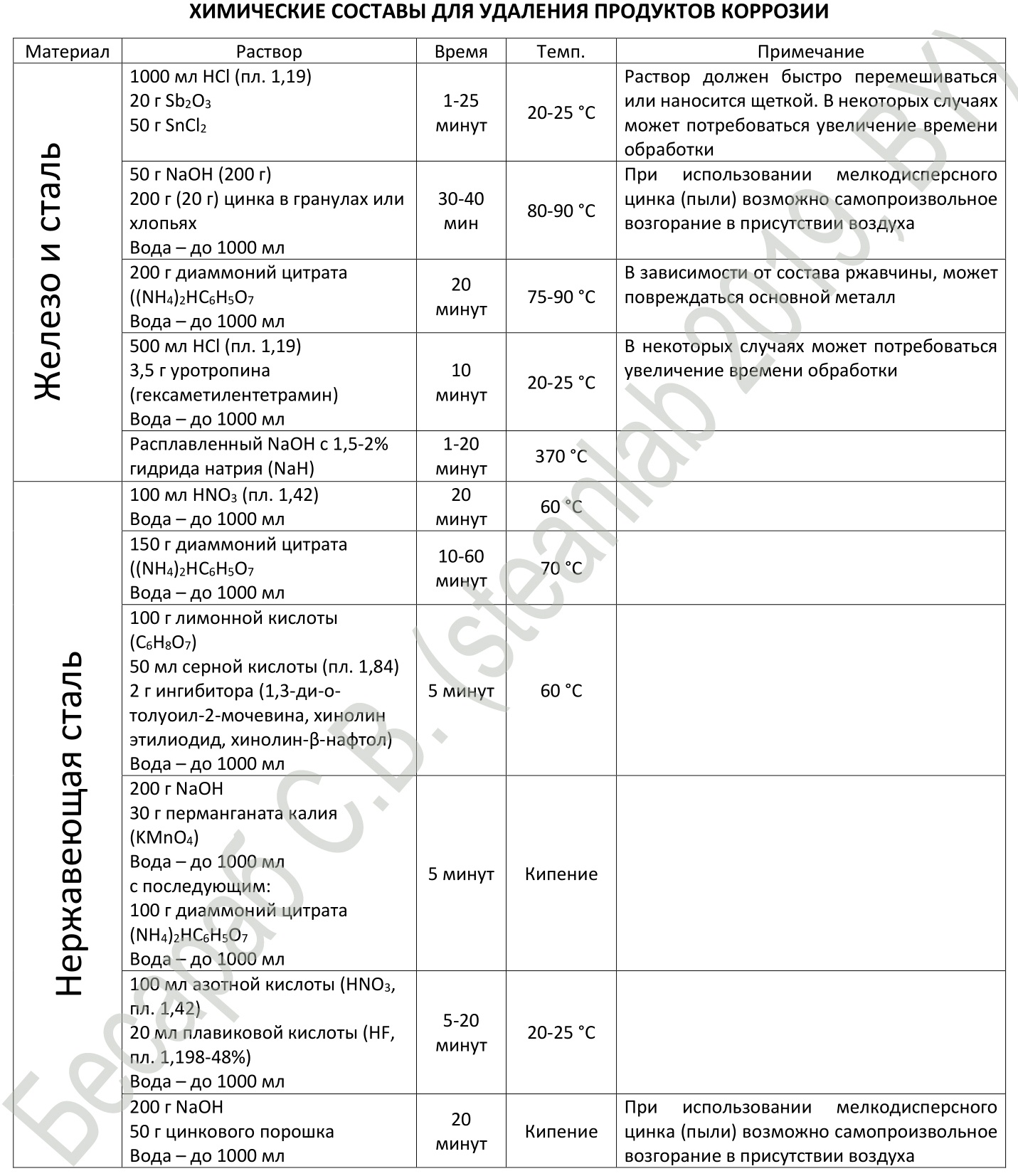
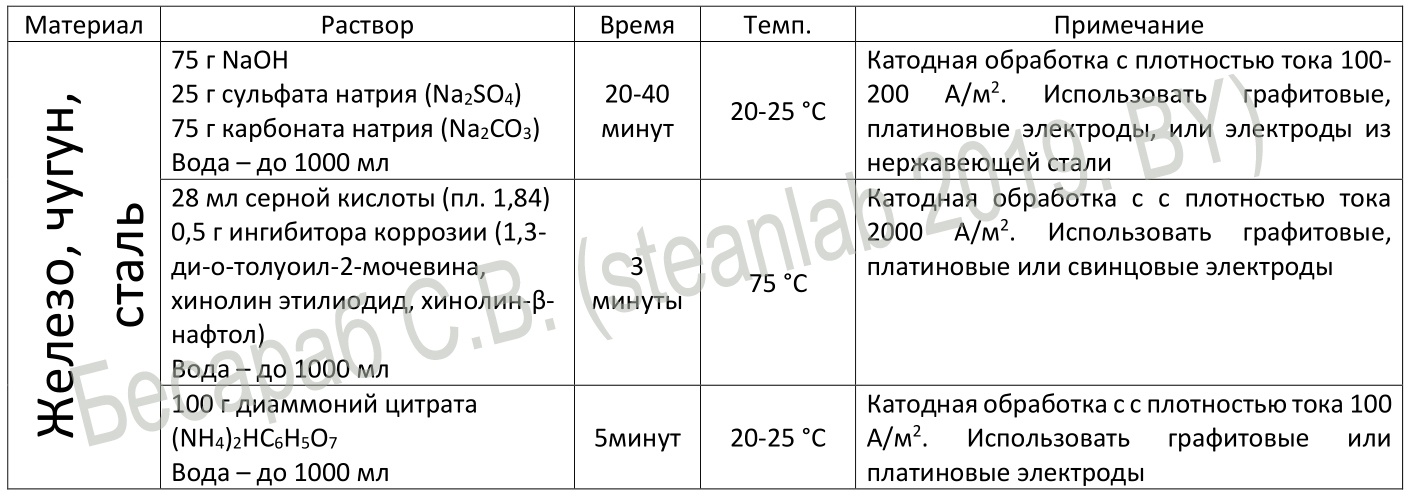
И, для любителей быстрой езды электролиза — составы для электрохимической очистки. Процесс действительно серьезно ускоряется, по сравнению с химической обработкой.
Замечание от коллоидного химика: нужно понимать, что в случае резьбы (в противоположность ржавчине на поверхности), для того чтобы разрушить все оксиды вдоль резьбы упомянутые выше составы должны до них добраться (реакция идет только в месте непосредственного контакта между реагентом и оксидом). А сделать это довольно сложно, так как все пути проникновения плотно забиты не успевшей еще прореагировать ржавчиной. Поэтому помимо эффективности растворения следует учитывать и эффективность смачивающего действия реагента (способности проникать в поры, микротрещины и капилляры). Именно этим вопросам и посвящен следующий раздел.
Снижение трения или «смазывая обломки...»
Как я уже писал выше, после химического, термического или механического разрушения оксидных слоев ржавчины необходимо уменьшить трение между ними. Логично, что сделать это можно с помощью смазки. Большинство «народных» средств, вроде различных масел, керосина, бензина, ацетона — никак не изменяют состояние ржавчины внутри «закисшего» болта, но вполне себе могут помочь в прокручивании гайки вместе с обломками оксидного слоя после проведения первичной обработки по разрушению пористого каркаса.
Важно! Заливать на «закисшую» резьбу любые углеводороды имеет смысл только в том случае, если путь вдоль резьбы не до конца забит оксидами, в таком случае растворитель в них проникает/адсорбируется и уже затем только выступает в роли смазки. Т.е. смачивать всякими керосинами нужно или не сильно приржавевшие болты или когда болт уже стронут и в оксидах образовались поры. Поэтому, учитывая выше изложенное (например, пункт термическое разрушение) логичным будет нанести «керосины» на заржавевшую резьбу, а затем одновременно с постукиванием по головке болта молотком или другим ударным инструментом попытаться сдвинуть гайку с места. Для чугунных и стальных водопроводных труб с резьбой знатоки рекомендуют нагревать заржавевшие места, наносить на них парафин из свечки, опять нагревать дожидаясь впитывания и проскальзывания растаявшего углеводорода по нитям резьбы и только потом пытаться раскручивать.
Замечание про WD-40. Многие наверное слышали про эту штуку, «триумф американской нефтехимии». Я, в отличие от некоторых друзей, не представляющих машину без пузырька WD-40 в бардачке, особого пиетета к этой смеси углеводородов не испытываю. Для тех, кто не в курсе, это раствор, который в 60-х годах прошлого века был разработан для защиты корпусов американских ракет от ржавчины и коррозии. Ну а потом, как водится, преимущества этой жидкости непонятного состава оценили и простые американцы. «WD-40» является аббревиатурой от термина «вытеснение воды, 40-я формула», т.е. на 40-й раз у них что-то получилось. Композиция WD-40 никогда не патентовалась, ради сохранения коммерческой тайны. Посему до сих пор толком не ясно, а что же там в составе оригинальной разработки. Узнать это с каждым годом все сложнее (так как по расказам знающих людей >90% WD-40 на нашем рынке — подделки), да и не нужно, так как уже 10 лет назад, журналисты из журнала Wired занесли этот «керосин» на газовый хроматограф+масс-спектрометр и установили, что в составе имеется: минеральное масло, декан, нонан, ундекан, тридекан, тетрадекан, циклогексан, диметилнафталин и углекислый газ чтобы создать необходимое давление в баллоне. MSDS (паспорт безопасности для рынка США) дает следующую информацию: 50% — алифатические углеводороды, <25% — нефтяное минеральное масло, 12–18% алифатический углеводород с низким давлением паров для уменьшения вязкости раствора (легко испаряющийся разбавитель), 2–3% углекислого газа, <10% инертных ингредиентов.
Упомянутый выше раствор часто хвалят за невероятную проникаемость (или проницаемость, не помню точно как фанаты WD это произносят). Если смотреть с точки зрения коллоидной химии, то окажется, что эти люди скорее всего имеют ввиду явление смачивания. Если кратко, то оно зависит от сил межмолекулярного взаимодействия и заключается в следующем: если силы взаимодействия между молекулами жидкости и твердого тела больше, чем между молекулами жидкости, то жидкость растекается по поверхности твердого тела, т.е. смачивает и наоборот, если силы взаимодействия между молекулами жидкости больше, чем между молекулами жидкости и твердого тела, то жидкость собирается в каплю и не смачивает поверхность жидкости. Напрямую это связано с такой штукой, как поверхностное натяжение.
Татко напамiнае: чтоб сын не забыл упомянуть про такую штуку как «красная тормозуха», она же жидкость тормозная БСК (аки «бутиловый-спирт-касторка» в соотношении 1:1).

В то время, как кто-то пользовался WD-40 из бардачка, у меня в случае, если разбрался какой-либо мотор и вдруг возникал намертво заржавевший крепеж — происходило следующее. Татко мой молча смотрел на это дело, потом молча шел в гараж и приносил шприц с красной жидкостью едкого запаха. Жидкость наносилась, выдерживалась минут 30 и… И действительно, в большинстве случаев срабатывало и гайку удавалось открутить. Справедливости ради замечу, что все крепежи для которых использовалась БСК находились в моторах, где какое-то количество смазки всегда было. Если честно, то весьма вероятно, что у отца в гараже до сих пор еще есть эта тормозная жидкость, хранимая именно на случай заржавевшего крепежа. В продаже такой вариант сейчас найти тяжело, потому что производители отказались от бутанола в пользу различных полигликолей и их эфиров, которые проникают в капилляры резьбы гораздо хуже. Возможно связано это с тем, что полигликоли подешевле, а может и потому что они более безопасны.
Дополнение: @Алексей Шукаев уточняет, что переход от бутанола к полигликолям связан с разницей в температуре кипения. «Переход в газообразное => сжимаемость => гидравлика перестает работать» — вот и пришлось отказаться…
На моей памяти были примеры случаев, когда народ, уставший от поиска денег на фабричную выпивку пил красную тормозную жидкость. Бутанол, как никак из того же ряда спиртов, что и этанол, пусть и обладает самой высокой среди простых спиртов токсичностью (LD50 составляет 2290-4360 мг/кг). Большая часть сивушных масел при производстве спирта дистилляцией — это именно бутанол. Именно он дарит зубодробительное, ни с чем не сравнимое похмелье. Но это когда «переварится». А касторовое масло, оно известно своим лечебным слабительным эффектом. В общем многофункциональный в СССР выпускали продукт…
Примечание: в современном мире, уставшем от безуспешных поисков смеси касторового масла с бутанолом, применяется его аналог (такого же цвета): трансмиссионное (красное) масло и ацетон в соотношении 1:1. Цвет похожий, эффективность тоже.
Паули (нобелевский лауреат, кстати) дополняли: «Я знаю, почему Ландау не пьет. Он пьян всегда. Он опьянен самой жизнью, ему не нужен алкоголь». Вот на кого, ребята, нужно равняться.
И что же из всего этого следует ?
А из всего этого следует то, что если жидкость (какой-нибудь растворитель) имеет поверхностное натяжение меньше чем вода, то она будет лучше смачивать ржавчину и быстрее проникать в поры и капилляры, чем водный раствор какой-нибудь кислоты. Проникать-то он будет лучше, но разрушить или ослабить связи между оксидными слоями никак не сможет. Вырисовываются следующие наблюдения:
1) WD-40, и всевозможные «жидкие ключи» (англ. liquid wrench) — представляют из себя обычные углеводороды и близкие к ним компоненты, обладающие низким поверхностным натяжением и способные хорошо смачивать пористые оксиды и проникать в их капилляры.

Эти, как правило нефтепродукты, отлично впитываются нитями резьбы и обеспечивают смазку. Только смазку, потому что сами по себе все компоненты инертны и не оказывают какого-либо заметного действия на ржавчину. От слова вообще. Поэтому лучше всего их использовать после/совместно с методами разрушения оксидных слоев описанными в статье. Печаль в том, что даже признанные RUST REMOVER-ы ничего что действительно бы ржавчину разъедало и отлично проникало не содержат
2) Всякие PB-Blaster-ы, Rust buster-ы и Rust dissolver-ы заявленные как растворители ржавчины, действительно ржавчину химически растворяют. Как правило в их составе имеется и компонент, снижающий поверхностное натяжение и дающий легкий смазывающий эффект. Но этот эффект является глубоко вторичным. Под спойлером пару известных примеров:

Cостав:
Ортофосфорная кислота — 10.0-30.0 % (= протонирующий растворитель ржавчины + фосфатирующий металл агент)
Изопропанол — 1.0-5.0 % (= «смазка» т.е. компонент обеспечивающий смачивание и проникновение)
Серная кислота — 0.1-1 % (= протонирующий растворитель ржавчины)
Вода — >50 %
Полисахариды — ? (= загуститель для создания правильной консистенции)
Далее некий Permatex Rust Dissolver Gel

Состав:
Вода — 40.0-70.0%
Фосфорная кислота — 10.0-30.0 % (= протонирующий растворитель ржавчины + фосфатирующий металл агент)
Изопропанол — 1.0-5.0 % (= «смазка» т.е. компонент обеспечивающий смачивание и проникновение)
Моноэтаноламин (MEA) — ? (= ингибитор коррозии)
Родамин — ? (= краситель)
Как можно заметить, используются все те же ядреные неорганические кислоты и спирты для придания им нужной подвижности и снижения поверхностного натяжения. + в некоторых случаях ингибиторы коррозии. Т.е. теоретически, каждый опытным путем может приготовить свой собственный растворитель ржавчины, смешивая любимую (=доступную) неорганическую кислоту со спиртом (имеющимся в доступности).
Важно: все описанные в статье химические способы разрушения и преобразования ржавчины могут быть использованы не только для растворения «закисшей» резьбы на болтах, но и при антикоррозионной обработке металла (железо/сталь/чугун) любой формы, а также при удалении ржавых разводов на сантехнике и т.п.
Ну и на закуску хотелось бы предложить такой факт. В последнее время, в связи со стремлением производителей химических составов соответствовать концепциям зеленой химии, постоянно идут поиски новых, более экологичных и биоразлагаемых компонентов. Не остались в стороне и всевозможные растворители и преобразователи ржавчины. Последний тренд — использование в качества преобразующего компонента (вместо привычной уже фосфорной кислоты и фосфата железа, например) органических соединений фенольной природы — таннинов. Дубильное действие этих веществ превращает красноватые оксиды железа в голубовато-черный устойчивый таннат. Вот вам и место, куда можно приложить вяжущую хурму с ее дубильными веществами :). Да и вообще, теоретически, вполне себе вариант заржавевшее дно любимого автомобиля, вместо токсичных неорганических кислот обрабатывать крепким настоем зеленого чая…
На этом расказ про ржавчину закончен, подписывайтесь на мои хабра- и Facebook заметки, чтобы знать больше!
Cергей Бесараб (Siarhei V. Besarab)
ASTM G1 — 03(2017)e1 Standard Practice for Preparing, Cleaning, and Evaluating Corrosion Test Specimens
www.armorvci.com/corrosion/types-of-rust
T. Kisato, Rust conversion agent for corrosion prevention. Japanese patent 2014, JP 2014169486 A 20140918.
M. Usman, J.M. Byrne, A. Chaudhary, S. Orsetti, K. Hanna, C. Ruby, A. Kappler, S.B. Haderlein, Magnetite and green rust: synthesis, properties, and environmental applications of mixed-valent iron minerals, Chem. Rev. 118 (2018) 3251–3304.
R.M. Cornell, U. Schwertmann, The Iron Oxides: Structure, Properties, Reactions, Occurrence and Uses, 2nd ed., Wiley-VCH, 2006.
Y.S. Choi, J.G. Kim, Aqueous corrosion behavior of weathering steel and carbon steel in acid-chloride environments, Corrosion 56 (2000) 1202–1210.
Hansen, H. C. B. Environmental Chemistry of Iron(II)-Iron(III) LDHs (Green Rusts). In Layered Double Hydroxides: Present and Future; Nova Science Publishers: Huntington, NY, 2001; pp 469−493.
Réguer,S.,Dillmann,P.,Mirambet,F.:In:Dillmann,P.,Béranger,G.,Piccardo,P.,Matthiessen,H.(eds.) Corrosion of metallic heritage artefacts, p. 170. Woodland Publishing Ltd., Cambridge (2007)
web.archive.org/web/20140119014037/http://www.wired.com/science/discoveries/magazine/17-05/st_whatsinside
Lange's Handbook of Chemistry (1967) 10th ed. pp 1661–1665
Автор: Cергей Бесараб (Siarhei V. Besarab)