При обосновании свойств атомов и молекул принято ссылаться на постулаты квантовой механики, в которых разбираются далеко не все физики. Тем более химики, у которых принципы Паули и Гейзенберга, правила Клечковского и Хунда, и даже уравнение Шрёдингера не вызывают никаких чувств, кроме чувства глубокого уважения к вышеупомянутым физикам. Ещё хуже гуманитариям и прочим художественным натурам, которым описывать и разъяснять подобные принципы, правила и уравнения бесполезно. В результате один из них – художник Кеннет Снельсон (Kenneth Snelson; 29.06.1927 — 22.12.2016) – решил, что «спасение утопающих – дело рук самих утопающих». И в 1960 году придумал простую теорию строения атома, которому он посвятил несколько десятков своих картин, и даже изваял из гранита /1/.

Рис. 1. «Атомные» скульптуры (4'x4'x4', гранит, 2009) /1/
Электроны в атомной модели Снельсона имеют кольцевую форму и формируют сферические электронные оболочки, состоящие из соприкасающихся электронных колец (“circle-sphere”). Модели таких «циклосфер» Снельсон построил из ферритовых кольцевых магнитов. Если их расположить на поверхности сферы, то при чередовании направления магнитного поля края смежных магнитов притягиваются друг к другу, и их внешние плоскости образуют многогранные (кольцегранные) оболочки.

Рис.2. Магнитные модели электронных оболочек Снельсона
Наиболее устойчивые «электронные» структуры получаются из двух, восьми, десяти и четырнадцати магнитов.
Таблица Менделеева по-Снельсону
По теории Снельсона такие устойчивые сочетания магнитов соответствуют четырём основным типам заполненных оболочек атомов, построенных из кольцевых электронов. Первый тип (2e–) соответствует гелию, атомный радиус которого равен 31 pm. Второй (8e–) характерен для благородных газов, замыкающих периоды в таблице Менделеева (Ne – 38 pm; Ar – 71 pm; Kr – 88 pm; Xe – 108 pm; Rn – 120 pm). Более крупными заполненными оболочками (10e–) обладают элементы подгруппы никеля (Ni — 149 pm; Pd – 169 pm; Pt – 177 pm). А оболочка из 14 электронов может формироваться у лантаноидов (Er – 226 pm) и, возможно, у актиноидов. При этом группирование химических элементов по типам внешних электронных оболочек атомов отражает их деление на малые (8e–) и большие (10e–+8e– или 14e–+10e–+8e–) периоды таблицы Менделеева.
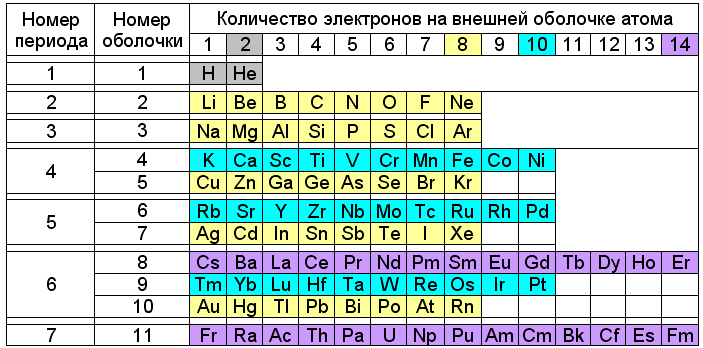
Рис. 3. Таблица Менделеева с делением периодов по-Снельсону
Положение некоторых элементов в этой таблице выглядит непривычно. Например, натрий, рубидий и цезий, несмотря на сходство химических свойств, оказываются в разных по окраске рядах – жёлтом (8e–), голубом (10e–) и сиреневом (14e–). А медь, серебро и золото окрашены так же, как литий и натрий – в жёлтый цвет. Но нужно учитывать, что внешние электроны элементов от лития до неона и от натрия до аргона формируют восьмиэлектронные оболочки, а от калия до никеля и от меди до криптона – десятиэлектронные. На том же основании жёлтым цветом выделены элементы от меди до криптона, от серебра до ксенона и от золота до радона, а голубым – от рубидия до палладия и от тулия до платины.
В данном случае химические свойства элементов с одним электроном на внешней оболочке определяются типом нижележащей заполненной электронной оболочки — восьмиэлектронной для щелочных металлов и десятиэлектроной для меди, серебра и золота.
Радиусы атомов в таблице Менделеева изменяются периодически – скачкообразно увеличиваются при переходе к каждому следующему периоду, но внутри периодов уменьшаются.
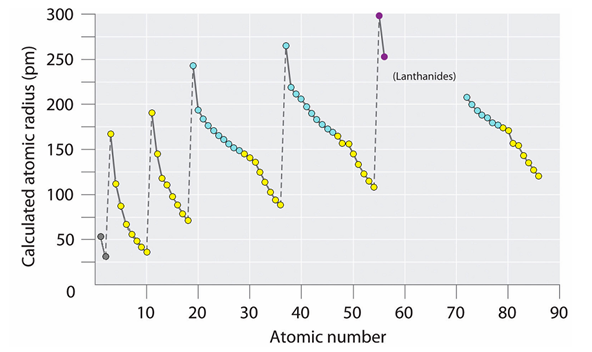
Рис. 4. Периоды атомных радиусов
https://catalog.flatworldknowledge.com/bookhub/4309?e=averill_1.0-ch07_s02
(с модификациями)
Отсюда следует, что радиусы кольцевых электронов в атомах также переменны и зависят от расстояния до атомного ядра, его заряда и типа электронной оболочки. На внешней оболочке они максимальны, причём особенно велики в начале периода, когда заряд атомного ядра (для данного периода) минимален. При этом тип заполняемой электронной оболочки зависит от атомного радиуса. Если он не больше 120 pm, то получаются восьмиэлектронные оболочки. Если больше 140 pm, то десятиэлектронные. На построение заполненной оболочки у более крупных лантаноидов (> 200 pm) требуется уже не меньше 14 электронов.
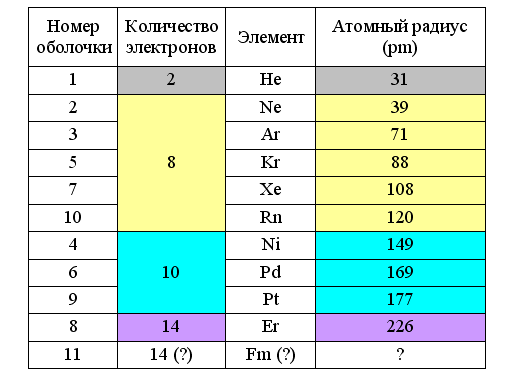
Рис. 5. Радиусы атомов с заполненными электронными оболочками
http://periodictable.com/Properties/A/AtomicRadius.bt.log.html
В таблице Менделеева с периодами, разделенными по-Снельсону, положение благородных газов, обладающих завершёнными восьмиэлектронными оболочками, выглядит вполне логично. Логично в ней смотрятся и элементы с заполненными десятиэлектронными оболочками. Это серебристые металлы, характеризующиеся высокой химической стойкостью и пластичностью (никель, палладий и платина). А вот построение 14-электронной оболочки лантаноидов должно завершиться у эрбия, который не отличается ничем примечательным ни от предшествующих диспрозия и гольмия, ни от следующих за ним тулия, иттерия и лютеция. Зато при переходе от лютеция к гафнию отмечается резкое увеличение плотности – с 9,85 до 13,2 г/см3. По-видимому, только на этой стадии, благодаря уменьшению атомного радиуса, становится возможным формирование устойчивой 14-электронной оболочки. И при её образовании остаются «лишние» внешние электроны. Поэтому в природе не существует элемента с 14-электронной завершённой внешней оболочкой, заметно отличающегося по химическим свойствам от соседних элементов.
Циклосферная теория строения электронных оболочек атомов, предложенная Снельсоном, неплохо согласуется с периодами таблицы Менделеева, поэтому было бы интересно оценить её согласованность и со свойствами молекул.
Восьмиэлектронные оболочки простейших молекул
Внешней оболочкой из восьми электронов, характерной для благородных газов, могут обладать и простейшие молекулы, содержащие водород. Например, молекула метана (CH4). Обычно в её моделях водород обозначают полусферой или отдельным шариком. В циклосферной (кольцегранной) модели восьмиэлектронная оболочка метана состоит из четырёх кольцевых электронов внешней оболочки атома углерода и четырех атомов водорода (протонированных электронов).
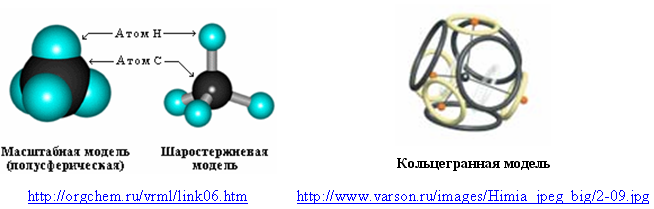
Рис. 6. Модели молекулы метана
Притяжение «водородных» электронов к протонам уменьшает их диаметры, а отталкивание протонов от положительно заряженного ядра немного выталкивает их из плоскости электронных колец. Но если сделать электроны невидимыми и соединить ядро углерода с протонами линиями, то кольцегранная модель молекулы метана приобретёт классический вид – симметричный, с одинаковыми углами (109,5°) между всеми атомами водорода.
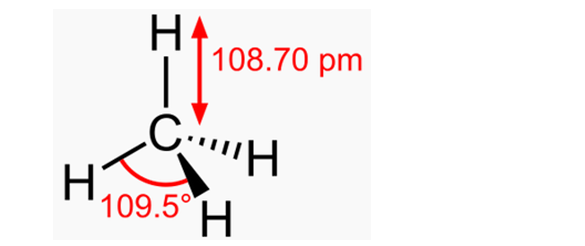
Рис. 7. Строение молекулы метана
Примерно так же могут выглядеть кольцегранные электронные оболочки аниона борогидрида (BH4–) и катиона аммония (NH4+). Но борогидридная должна быть немного крупнее, а аммонийная немного меньше метановой.
Восьмиэлектронную оболочку имеет и молекула аммиака (NH3), хотя потеря одного аммонийного протона лишает её положительного заряда, нарушает симметрию и немного изменяет углы расположения трёх оставшихся протонов. И такая же электронная оболочка, но немного меньшего диаметра, должна быть у катиона гидроксония (H3O+).
По такому же принципу можно построить восьмиэлектронную оболочку молекулы воды, у которой угол, образуемый ядром кислорода и двумя протонами, будет ещё меньше.
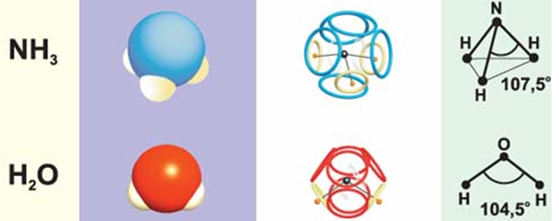
Рис. 8. Модели молекул аммиака и воды /2/
http://www.varson.ru/images/Himia_jpeg_big/2-09.jpg
Таким образом, можно выделить ряд простейших молекул и ионов с восьмиэлектронными оболочками, у которых нехватка внешних электронов компенсируется атомами водорода (протонированными электронами). Для элементов второго периода это BH4–, СН4, NH4+, NH3, H3O+, H2O, OH–, HF и F–. Замыкает второй период неон, которому не требуются протоны для нейтрализации суммарного отрицательного заряда электронов внешней оболочки атома.
По такому же принципу строятся внешние восьмиэлектронные оболочки у молекул SiH4, PH3, SH2 и HCl, образуемых элементами третьего периода таблицы Менделеева. Атомы водорода, принимающие участие в построении электронных оболочек таких молекул и ионов, влияют на их форму и химические свойства, но не изменяют общую структуру.
Во всех подобных моделях взаиморасположение тяжёлых ядер, имеющих внутреннюю электронную оболочку, и «голых» протонов находится в хорошем соответствии с давно известными «канонизированными» структурами данных простейших молекул. И по теории Снельсона взаиморасположение центрального ядра и протонов объясняется устойчивостью восьмиэлектронных внешних оболочек у подобных молекул, образуемых атомами II и III периодов таблицы Менделеева.
Сходства и различия электронных оболочек таких простейших молекул хорошо отражают (и неплохо объясняют) их известные структурные параметры, но с молекулами воды всё может быть сложнее. Кроме обычной «мета-воды», у которой протоны расположены под углом 104,5°, должна существовать и «пара-вода», у которой протоны лежат на одной прямой с ядром кислорода (180°). Причём у «мета-воды» ядра атомов водорода (протоны) могут находиться или в «северных» (N), или в «южных» (S) электронах. У «пара-воды» такая магнитная изомерия отсутствует, поскольку её протон-содержащие электроны имеют противоположную (по отношению к центру молекулы) ориентацию магнитного поля.
Структурная и магнитная изомерия электронных оболочек молекул воды у циклосферных моделей противоречит её общепринятым описаниям. Это могло бы послужить доказательством ошибочности теории Снельсона, если бы не удивительное многообразие свойств воды, не находящее объяснений в рамках общепринятых представлений о единственном варианте её молекулярного строения.
Магнитная изомерия должна быть характерна для электронных оболочек и многих других молекул. Но эту тему, как и теоретическое обоснование свойств воды, лучше обсуждать отдельно.

Рис. 9. Магнитные изомеры простейших молекул (люверсные модели электронных оболочек)
Отдельного рассмотрения заслуживают многочисленные соединения углерода, у которых электронные оболочки должны заметно отличаться от оболочек описанных выше простейших молекул.
Электронные оболочки углеродных соединений
Для соединений, состоящих только из углерода, характерно чрезвычайное многообразие молекулярных структур, образующих материалы с уникальными свойствами (карбин, графен, фуллерен, нанотрубки, алмаз и т.п. /3/). После награждения Нобелевскими премиями открывателей фуллерена (1996 г.; Р.Кёрл, Х.Крото, Р.Смоли) и графена (2010 г.; А.К.Гейм, К.С.Новосёлов) большую популярность приобрели предсказания и поиски новых форм углерода. В результате таких предсказаний были описаны молекулы графина, графдина, фаграфена и других преимущественно гипотетических соединений углерода.
Проще всего устроен карбин – линейный полимер углерода /4/. Сборка модели его электронной оболочки не вызывает затруднений, поскольку на внешней оболочке атома углерода находятся четыре электрона. Эти электроны образуют «кубик» с двумя незаполненными гранями. Сборка из таких «кубиков» линейного полимера даёт карбин.

Рис. 10. Карбин
Высокая ломкость карбина позволяет ему изгибаться и формировать замкнутые кольца. Из-за обязательности чередования полюсов магнитного поля у смежных электронов кольца могут содержать только чётное количество атомов углерода. Особенно устойчивыми должны быть кольца с шестью атомами углерода (гексамеры, С6), электроны которых могут соединяться под различными углами и формировать электронные оболочки различных типов. Наиболее известные структуры образуют «нобелевские» молекулы — графен и фуллерен. Построить для них модели электронных оболочек снельсоновского типа не трудно, если использовать при таком построении отличающиеся типы соединения гексамерных углеродных колец – графеновое (2D) и фуллереновое (3D).

Рис. 11. Основные 2D- и 3D-формы углерода
Фуллерены получили своё название в честь выдающегося американского архитектора, дизайнера и изобретателя Ричарда Фуллера. Но большой вклад в теории знаменитого Фуллера внёс его менее знаменитый сотрудник и не менее талантливый изобретатель Кеннет Снельсон. Поэтому было бы неплохо присвоить каким-нибудь ещё неоткрытым углеродным молекулам его имя. Тем более что теория Снельсона позволяет не только описывать уже известные формы углерода, но и предсказывать ещё не известные науке его разновидности. Можно построить множество таких структур, но их, как правило, отличает не только повышенная гибкость и ломкость, но и способность формировать сцепленные трёхмерные конгломераты, что затрудняет выделение индивидуальных химических веществ из смеси близких структурных аналогов.
Построить электронные оболочки снельсоновского типа можно и для наиболее прочной формы углерода — алмаза. Причём не только для его обычной разновидности, но и для более редкой и малоизученной формы — лонсдейлита.

Рис. 12. Строение алмазных электронных оболочек
Кристаллическую решётку алмаза можно считать трёхмерным полимером метана, у которого все атомы водорода замещены углерод-углеродными «дырочными» связями. Каждый атом углерода окружён четырьмя электронами и четырьмя межатомными связями, причём между электронными оболочками отдельных атомов есть небольшие промежутки. При этом каждый электрон сцеплен с шестью соседними электронами.
В кристалле лонсдейлита атомы углерода обладают восьмиэлектронными оболочками, причём все образующие их электроны служат межатомными перегородками («электронные» связи). В результате на каждый атом углерода приходится по четыре «целых» электрона. Точнее — по восемь их «половинок», поделённых между смежными атомами. У лонсдейлита, в отличие от обычного алмаза, отсутствуют межатомные промежутки. При этом каждый электрон также связан с шестью соседними электронами.
Аналогичные варианты структуры электронных оболочек могут иметь кристаллы и других особо твёрдых веществ – муассанита (SiC), боразона (γ-BN) и фосфида бора (BP). Высокая твёрдость всех подобных соединений хорошо объясняется структурой их электронных оболочек, в которых каждый электрон связан с шестью соседями. У обычных молекул электроны имеют не больше четырёх таких связей.
Снельсоновская теория строения молекулярных электронных оболочек неплохо объясняет многообразие аллотропных форм углерода, но для доказательства её универсальности желательно проверить эту теорию и на других соединениях углерода. В первую очередь – на хорошо изученных углеводородах.
Электронные оболочки углеводородов
Алканы, т.е. насыщенные углеводороды с общей формулой СnH2n+2, можно считать производными метана, у которого некоторые протонные электроны замещены «дырочными» углерод-углеродными связями. Тройка простейших молекул такого типа включает этан, пропан, бутан и изобутан.

Рис. 13. Модели электронных оболочек простейших алканов
Для пропана и других алканов, имеющих нечётное количество атомов углерода в неразветвлённой цепочке, характерна магнитная изомерия. У линейных насыщенных углеводородов с чётным количеством атомов углерода магнитная изомерия отсутствует. А при увеличении количества углеродных атомов в молекуле количество магнитных, структурных и поворотных изомеров (ротамеров) возрастает в геометрической прогрессии.

Рис. 14. Магнитные, структурные и поворотные изомеры пентана
Еще больше изомеров можно построить для гексана, но это не относится к циклическим насыщенным углеводородам. Например, у циклогексана магнитные изомеры отсутствуют, хотя если рассматривать макет его электронной оболочки со стороны, то можно увидеть, что однонаправленные спины у верхних и нижних электронов имеют противоположную ориентацию.

Рис. 15. Модель электронной оболочки циклогексана (C6H12) (две стороны одной «медали»)
Оригинальную электронную оболочку имеет молекула бензола (C6H6), содержащая шесть симметричных планарно расположенных атомов водорода. Построить такую оболочку из гексамера C6, характерного для графена или фуллерена, невозможно. Но она легко строится на основе кольца из шести сцепленных электронов, образующих центральный шестигранный цилиндр. В этой конструкции на каждый атом углерода приходится по пять электронов – четыре собственных и один «водородный». Такое строение объясняет и низкую плотность бензола (0,876 г/см³), и симметричность структуры молекулы, и планарность расположения атомов водорода, и их способность замещаться радикалами, которым для завершения восьмигранных оболочек не хватает одного электрона.

Рис. 16. Электронная оболочка молекулы бензола
Характерные для бензольных атомов углерода пятичленные соединения кольцевых электронов неоднократно встречаются на картинах Снельсона, и было бы странно, если бы они отсутствовали в химических соединениях.

Рис. 17. Пятиэлектронные оболочки Снельсона /1/
Исходя из описанного выше варианта электронной оболочки бензола, можно построить оболочки для его многочисленных производных с различными боковыми радикалами, а также с атомами азота, частично или полностью замещающими углерод центрального кольца.

Рис. 18. Макеты электронных оболочек простейших производных бензола
Внешняя электронная оболочка этилена (C2H4) — простейшего представителя алкенов (CnH2n) – легко строится из восьми обычных и четырёх протонированых электронных колец. Аналогичные 12-электронные оболочки могут иметь молекулы диимида (N2H2), кислорода (O2) и формальдегида (СH2O).

Рис. 19. Макеты молекул с 12-электронными оболочками
Все остальные алкены, диены и триены можно считать алканами, содержащими одну, две или три этиленовые группы.
Углеводороды, относящиеся в алкинам (CnH2n-2), содержат пару атомов углерода, объединённых вытянутой 10-электронной оболочкой. На каждый из атомов углерода приходится по четыре электрона, поэтому недостающие позиции у ацетилена застраиваются двумя атомами водорода, а у остальных алкинов эти водороды замещаются одной или двумя «дырочными» связями с электронными оболочками соседних атомов.
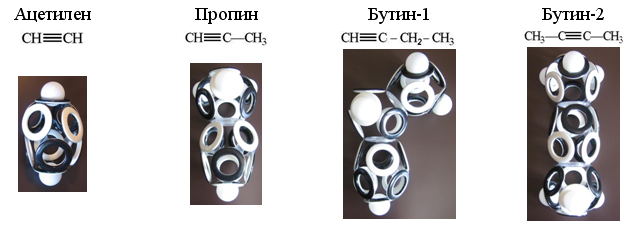
Рис. 20. Макеты электронных оболочек простейших алкинов
Таким образом, для всех основных типов углеводородов — алканов, аренов, алкенов и алкинов – можно построить модели внешних электронных оболочек, удовлетворяющих всем канонам теории Кеннета Снельсона. Причём такие оболочки могут служить образцами для молекулярного макетирования соединений, содержащих не только углеродные атомы. Показательными примерами могут служить описанные выше 12-электроные оболочки аналогов этилена — диимида, кислорода и формальдегида. По аналогии с ними было бы интересно рассмотреть снельсоновские оболочки более сложных молекул, содержащих 10-электронные структуры ацетиленового типа.
Молекулы с десятиэлектронными оболочками
Сферическая оболочка, построенная из десяти электронных колец, способна вытягиваться в различных направлениях. Лучше всего — по оси симметрии, проходящей через пару находящихся на «полюсах» электронов. У химически нестойкого ацетилена (C2H2) эта ось проходит через атомы водорода. У отличающегося химической стойкостью молекулярного азота (N2) атомы водорода отсутствуют, и вытянутая электронная оболочка отличается повышенной прочностью. Подобную снельсоновскую 10-электронную оболочку можно построить и для некоторых других простейших молекул.

Рис. 21. Макеты 10-электронных оболочек простейших молекул
Более сложные электронные оболочки, содержащие вставки 10-электронных элементов, могут иметь молекулы мочевины, ацетона, ацетамида, угольной и уксусной кислот, а также гуанидина. Характерной особенностью всех молекул подобного типа является их магнитная изомерия и наличие межатомных связей с электронными вставками («электронные» связи).

Рис. 22. Макеты оболочек молекул с 10-электронными центральными группами
Особенно часто в органических соединениях встречается 10-электроная группа окиси углерода (СО). Некоторые гетероциклические соединения содержат по две, три или даже по четыре такие группы.
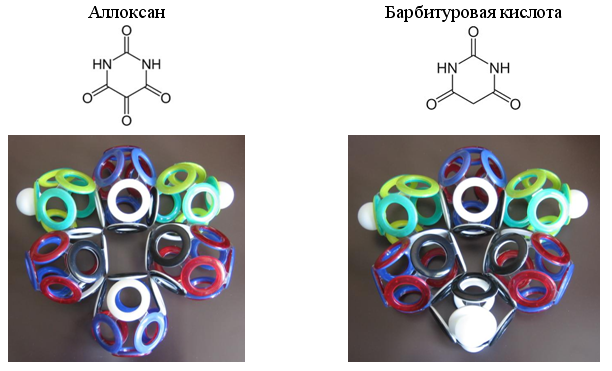
Рис. 23. Примеры гетероциклов с 10-электронными группами СО
Характерной особенностью электронных оболочек таких молекул является наличие межатомных связей лонсдейлитового типа (со вставками межатомных электронов). Подобные «электронные» связи могут присутствовать и у многих других молекул. Например, у полииодидов (I3-, I5-, I7-, I9- и др.), кристаллизующихся из растворов, содержащих иодиды (I-) и йод (I2) /5/.

Рис. 24. Макет электронной оболочки аниона I3- с межатомными связями лонсдейлитового типа
Разобрать структуру электронных оболочек многочисленных соединений галогенов было бы очень интересно, но только для ограниченного круга химиков. Поэтому лучше проверять правильность предложенной Снельсоном теории построением электронных оболочек более известных молекул — белков, ДНК и т.п…
Биомолекулы
Основным структурным элементом всех белковых молекул является пептидная связь. Совпадение её известных параметров с параметрами кольцегранной электронной оболочки может служить хорошим доказательством правильности теории Снельсона. А несовпадение – опровержением.
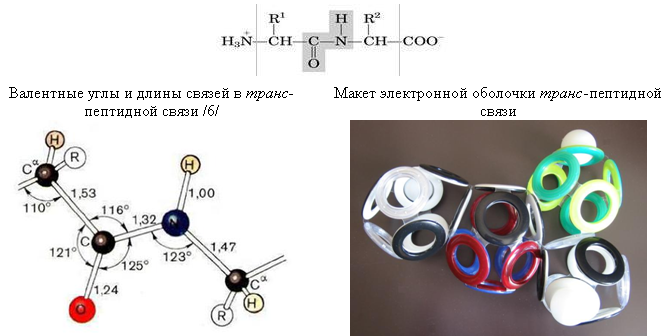
Рис. 25. Пептидная связь
Люверсная модель отображает только электронную оболочку, что не позволяет точно определить углы между центрами атомов. Тем не менее, общее их расположение вполне соответствует схемам из учебников /6/. Например, на макете хорошо видна планарность трёх связей пептидного атома азота, которые у большинства его соединений располагаются пирамидально. Такая планарность может объясняться присутствием межатомного электрона между 10-электронной оболочкой CO и восьмигранной оболочкой атома азота. Этот электрон примыкает к незаполненной электроном («дырочной») связи N-C (обозначена прозрачным люверсом), и наиболее устойчивым положением для протонированного электрона (атома водорода) в таком случае становится противоположная грань оболочки атома азота.
Уменьшение длины пептидной связи (CO)-N (1,32 Å) по сравнению с длиной одинарной связи C-N (1,47 Å) также может объясняться присутствием в ней межатомного («лонсдейлитового») электрона. Таким образом, в макете электронной оболочки пептидной связи, построенной в соответствии с теорией Снельсона, отсутствуют какие-либо принципиальные несоответствия с общепринятыми представлениями о её структуре.
Построение кольцегранных электронных оболочек, по-видимому, применимо и для моделирования пространственной структуры белков, но для крупных молекул удобнее использовать не люверсные и подобные им макеты, а компьютерное 3D-моделирование. Попытки такого моделирования подробно рассмотрены в недавно вышедшей монографии /7/.
Ещё одно доказательство правильности теории Снельсона может быть построено на макетировании электронных оболочек четырёх оснований ДНК. И на демонстрации наличия водородных связей в парах комплементарных оснований АТ и GC.
При описании электронных оболочек этих азотистых оснований желательно придерживаться общепринятой нумерации атомов пиримидиновых (С и Т) и пуриновых (А и G) азотистых оснований, показанной на рисунке.
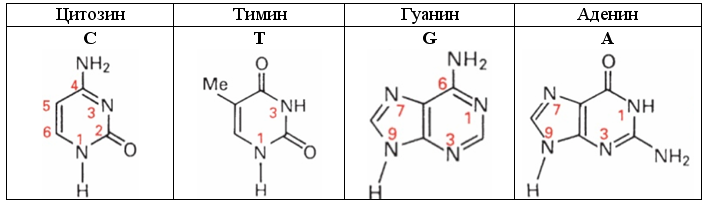
Рис. 26. Азотистые основания ДНК
Характерной особенностью структуры оснований C, T, G и A, а также их пар в ДНК, является планарность. Отсюда следует, что по крайней мере некоторые связи атомов азота в этих основаниях могут быть или идентичны, или аналогичны планарной пептидной связи CO-N. Планарность связей характерна также для образующих бензол десятиэлектронных пар -СH=СH- и -СH=N-, входящих в состав таких аналогов бензола, как пиримидин и пиразин. Десятиэлектронных пар атомов бензольного типа у цитозина две (С5-С6, N3-С4), у тимина одна (С5-C6), у аденина четыре (С4-С5, N1-С6, С2-N3, N7-С8) и у гуанина три (С4-С5, С2-N3, N7-С8).
В разнообразных связях пуриновых и пиримидиновых гетероциклов легко запутаться, поэтому лучше рассматривать их на макетах электронных оболочек.

Рис. 27. Макеты электронных оболочек азотистых оснований (атом кислорода дезоксирибозы обозначен восьмиэлектронной оболочкой из прозрачных люверсов)
В кольцегранных электронных оболочках азотистых оснований встречаются по крайней мере пять типов межатомных связей:
• электронные (лонсдейлитового типа, с межатомной вставкой электрона);
• дырочные (без электронной вставки);
• бензольные (связи -С=С- и -N=C- с парами пятиэлектронных оболочек);
• десятиэлектронные (СО);
• веерные (четвёрки электронных колец, сцепленных в одной точке).
Например, у цитозина имеется четыре электронные связи (N1-C2, C4-C5, C4-(NH2) и C6-N1), одна дырочная (N1-dRib), две бензольные (N3-C4, C5-C6), одна десятиэлектронная (C2O) и одна веерная (C2-N3). У тимина — четыре электронные связи (N1-C2, C2-N3, N3-C4 и C6-N1), две дырочные (C5-(CH3) и N1-dRib), одна бензольная (C5-C6), две десятиэлектронные (C2O, C4O) и одна веерная (C4-C5). Всё это, конечно, интересно, но интереснее было бы посмотреть на наличие водородных связей у комплементарных пар азотистых оснований.
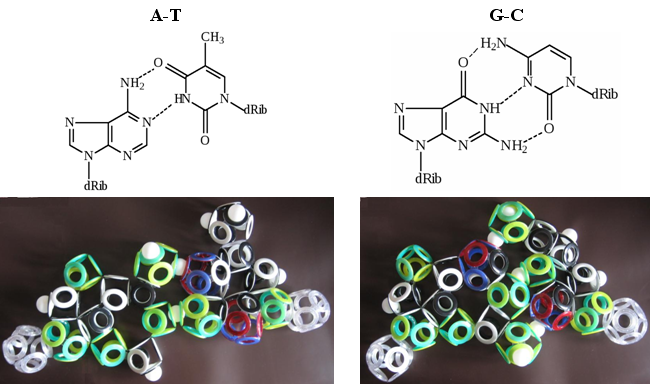
Рис. 28. Комплементарность азотистых оснований
На люверсных моделях снельсоновских электронных оболочек хорошо видны две водородные связи в паре AT и три – в GC. Вряд ли это может быть простым совпадением. И для тех, кто разбирается в тонкостях структуры ДНК, это может служить неоспоримым доказательством правильности теории Кеннета Снельсона. Единственным камнем преткновения для них окажется магнитная изомерия электронных оболочек всех биомолекул, не вписывающаяся в современные представления об их структуре.
Магнитные изомеры биомолекул вряд ли можно различить какими-либо физическими методами, но их органолептические свойства должны сильно отличаться, что можно продемонстрировать на примере магнитных изомеров этанола (C2H5OH).

Рис. 29. Магнитные изомеры этанола
Как известно, этанол даже высшей очистки, разведённый до стандартной концентрации 40%, без закуски и в неохлаждённом виде пить практически невозможно. А вот свежий самогон той же концентрации пьётся даже тёплым. Закуска и в этом случае будет не лишней, но если выпить немного, то можно обойтись без неё. Проверить это способен любой химик, располагающий элементарным оборудованием. И даже не химик, если он предпочитает полагаться на собственный опыт и имеет самогонный аппарат.
Теория Снельсона позволяет объяснить сей факт сохранением магнитной изомерии этанола в свежем самогоне и рацемизацией его молекул в очищенном спирте, а вот квантовая механика здесь бессильна. Но не стоит разубеждать знатоков квантовой механики такими примерами. Не поймут.
Заключение
Теория строения электронных оболочек атомов и молекул, предложенная Кеннетом Снельсоном, вряд ли сможет в ближайшем будущем конкурировать с квантово-механическими представлениями, опирающимися на стройную систему постулатов. Основной постулат этой системы – принцип неопределённости Гейзенберга – не удалось опровергнуть даже Эйнштейну, поэтому при встрече со знатоками квантовой механики не пытайтесь с ними спорить. И постарайтесь не улыбаться. Это раздражает окружающих.
СПИСОК ЛИТЕРАТУРЫ
1. Kenneth Snelson; Art and Ideas / In association with Marlborough gallery, N.Y., 2013, NY, 174 Р. http://kennethsnelson.net/KennethSnelson_Art_And_Ideas.pdf
2. Кожевников Д.Н. Создание и использование комплекса моделей атомов и молекул для изучения строения вещества в курсе химии средней школы // Дисс. на соискание уч. степени канд. пед. наук, 2004. – 171 с.
3. Хайманн Р.Б., Евсюков С.Е. Аллотропия углерода // Природа. 2003. — №8. — с.66-72.
4. Сладков А. М., Кудрявцев Ю. П. Алмаз, графит, карбин — аллотропные формы углерода // Природа. — 1969. — № 5. — с.37-44.
5. Иванов Д.М., Иванов М.Г. Химия галогенов // Учебное издание. — 2014. — Изд-во Уральского университета. — 82 с.
6. Овчинников Ю.А. Биоорганическая химия // 1987. — M.: изд-во «Просвещение», 814 с.
7. Соколик В.В., Кушелев А.Ю. Геометрия живого наномира. Пикотехнология белков / Изд-во Lambert Academic Publishing, 2016. – 292 с.
P.S.: Из-за ограниченных возможностей текстового редактора формулы многих химических соединений искажены до неузнаваемости. Вариант статьи в формате PDF можно посмотреть здесь: https://yadi.sk/i/CYDYTGP43M78sP
Автор: genseq
