В интернете есть множество инструкций как сделать «съедобные» батарейки из лимонов, и т.д. Но съедобность таких устройств под вопросом, так как электроды, как правило, представляют из себя металлические пластины (обычно цинк и медь), а съедобным является, по сути, только электролит, роль которого играет лимон. Недавно я задалась вопросом, а можно ли создать полностью съедобную батарейку?
Сразу поясню, батарейка должна быть не из биосовместимых, а именно из съедобных компонентов. Конечно, легко можно было бы сделать съедобный суперконденсатор из активированного угля, но, как известно, энергоёмкость суперконденсаторов очень низкая по сравнению с аккумуляторами.
Самая главная трудность такой идеи- найти подходящие электроды/токоприёмники. Надо, во-первых, чтобы съедобный материал обладал хорошей проводимостью, а во-вторых, мог бы участвовать в электрохимических реакциях. И первое, что приходит на ум когда размышляешь о съедобных проводниках- пищевые красители Е174 и Е175, они же пищевое золото и серебро. Но в каких электрохимических реакциях могут быть использованы эти материалы, если они стоят недалеко друг от друга в электрохимическом ряду напряжений? Но тут надо вспомнить, что золото и серебро обладают электрокаталитической активностью. А где в электрохимических источниках питания используются катализаторы? В топливных элементах!
Как же работает топливный элемент? Так же как и другие электрохимические источники питания, топливные элементы имеют два электрода, погружённые в электролит. Но отличие от аккумуляторов и суперконденсаторов, эти электроды являются не активными материалами, а катализаторами, на которых происходит окисление «топлива», которое подводится извне, и восстановление окислителя. Например, в классическом примере топливного элемента на водороде, топливом является водород, а окислителем- кислород. Кстати, по сравнению с другими электрохимическими источниками питания, например, аккумуляторами и суперконденсаторами, топливные элементы самые энергоёмкие, так как они работают, пока к электродам подводятся реагенты. Но их недостаток- низкая мощность, ограниченная скоростью электрохомических реакций и скоростью подвода топлива и окислителя к электродам.

Но вернёмся к идее съедобного топливного элемента. Если роль окислителя может играть кислород из воздуха, то что можно использовать в виде съедобного топлива? Поискав варианты топливных элементов в научной литературе, я наткнулась на интересное решение. Оказывается, в виде топива может использоваться обыкновенная глюкоза, и такой тип устройств называется абиотический топливный элемент.
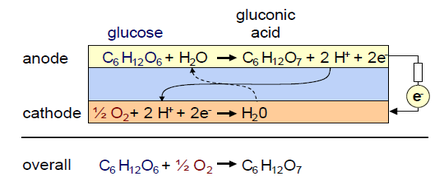
Напряжение такий ячеек обычно меньше 0.5 V, токи- пара десятков микроампер на квадратный сантиметр электрода, так что телефон таким устройством не зарядить, но в данный момент абиотические топливные элементы разрабатываются для использования как элементы питания в биомедицинских микроэлектромеханических системах (БиоМЭМС), которые должны имплантироваться в человеческое тело. Почему «абиотические»? А дело в том, что существует несколько видов топливных элементов, использующих глюкозу в виде топлива: энзиматические, микробные и абиотические. Энзиматические топливные элементы используют изолированные ферменты для окисления глюкозы. Но проблема в том, что ферменты быстро деактивируются, и такие системы обычно быстро теряют мощность, что для имплантируемых систем является большой проблемой. Микробные топливные элементы, в свою очередь, используют микроорганизмы, что тоже непрактично для применения внутрь из-за рисков инфекции. В отличие от вышеописанных систем, абиотические топливные элементы для переработки глюкозы используют не живые организмы или биомолекулы, а благородные металлы.
Идеальный дизайн такого устройства выглядит следующим образом: два металлических катализатора погружаются в раствор глюкозы, в котором также присутствует растворенный кислород. При этом, один из электродов является избирательным катализатором для окисления глюкозы, а другой- для восстановления кислорода. То есть, съедобный топливный элемент можно было бы теоретически сделать в виде сладкого желе, с одной стороны покрытого пищевым золотом, которое бы окисляло глюкозу, а с другой-серебром, восстанавливающим кислород. Но будет ли такое устройство работать?
И тут мы сталкиваемся со второй сложностью для создания съедобного топливного элемента: большинство благородных металлов имеют каталитическую активность и к окислению глюкозы, и к восстановлению кислорода. То есть, даже если серебро менее «чувствительно» к глюкозе и имеет лучшую каталитическую активность для восстановления кислорода, напряжение нашей ячейки будет меньше 0.5 V, так как на аноде и катоде будет параллельно идти реакция восстановления кислорода.
В общем, хотелось бы проверить эти теоретические размышления на практике, так что в следующих постах будет рассказано о попытках сконструировать съедобный абиотический топливный элемент в домашних условиях.
Автор: LadyN






