Введение
Для эукариотических геномов характерно наличие большого количества интронов, микро- и минисателлитов, диспергированных элементов, «реликтовых ретровирусов» и прочих нуклеотидных последовательностей, суммарная длина которых более чем на порядок превосходит длину генных экзонов, определяющих первичную структуру белков. Обычно считают, что избыточная ДНК является реликтом эволюции и только засоряет клеточное ядро. В лучшем случае ей отводится роль радиопротектора, защищающего гены от повреждений /1/.
Такие объяснения достаточно правдоподобны, но недостаточно убедительны. Трудно убедить себя в том, что наш геном является мусорным ящиком, набитым эволюционными отбросами или даже вредными для организма эгоистичными нуклеотидными последовательностями. Возможная радиопротекторная роль этого “мусора” служит слишком слабым утешением.
Особенно контрастно избыточность генома человека проявилась после завершения его секвенирования. Выяснилось, что в гаплоидном наборе хромосом содержится меньше 30 тысяч генов, и на каждый ген приходится примерно 100 тысяч нуклеотидов. Это значит, что в кодировании белков принимает участие менее 2% хромосомной ДНК.
Парадоксальность избыточности генома и непостижимость молекулярных основ человеческого разума являются самыми интригующими загадками современной биологии. А что, если эти две загадки имеют общую разгадку?
Компьютерные аналогии
Попытки понять принципы работы человеческого , как правило, основываются на поиске аналогий между строением центральной нервной системы и устройством компьютера. Нервам при этом отводится роль проводников электрических импульсов, а клетки головного
В последние годы повышенное внимание уделяется теоретической и экспериментальной проработке идеи квантового компьютера, оперирующего не с битами, а с кубитами, т.е. с квантовыми битами, носителями которых служат фотоны, электроны, атомы или возбуждённые молекулы. Содержащаяся в кубитах информация обрабатывается параллельно, что требует использования специальных алгоритмов, но реализация данного подхода позволит создавать суперкомпьютеры микроскопических (молекулярных) размеров, способные практически мгновенно выполнять сложнейшие вычисления /2/.
Разумеется,
Центральный биопроцессор
При современном уровне развития молекулярной биологии очень трудно представить себе, что в
Условия для взаимодействия информационных молекул имеются только в клеточном ядре. В нем сосредоточена вся хромосомная ДНК и значительная часть РНК. Это означает, что именно ядро способно служить центральным биопроцессором.
Цитоплазма отделена от ядра мембраной, которая с высокой избирательностью транспортирует участвующие в экспрессии генов молекулы РНК, т.е. те самые молекулы, назначение которых вполне понятно. Следовательно, цитоплазма не содержит (или почти не содержит) информационных молекул, кодируемых избыточной частью генома, и может претендовать только на роль периферийного устройства, соединённого с биопроцессором.
Если подобное предположение справедливо, то многоклеточный эукариотический организм следует считать мультипроцессорным устройством, состоящим из множества автономных ядерных биопроцессоров. Информация от ядра к цитоплазме передаётся в форме мРНК, кодирующей белки, но для межклеточного (межъядерного) обмена информацией должны использоваться какие-то вторичные химические или физические сигналы, поскольку ограничивающие цитоплазму клеточные мембраны, как правило, непроницаемы для нуклеиновых кислот.
Молекулярный биокомпьютер
Идея использования нуклеиновых кислот в качестве молекулярных элементов вычислительных устройств не нова /4, 5/. Существует даже теория волнового генома, приписывающая ДНК способность воспринимать, обрабатывать и излучать информацию в виде модулированного электромагнитного излучения /6/. К сожалению, подобные идеи и теории не позволяют понять сущность элементарных логических операций, на которых может быть основано ядерное
Взаимодействие информационных молекул между собой происходит параллельно, и описать последовательность событий практически невозможно по причине отсутствия самой последовательности. Представьте себе, что Вы прочли этот текст не по словам, а восприняли его целиком. Затем, не делая отдельных умозаключений, измените своё представление об окружающем мире. Возможно, именно так работает ядерный биопроцессор, у которого результатом обработки информации является изменение состояния системы информационных молекул.
Структуральная лингвистика
Последовательности нуклеотидов, обеспечивающие информационные функции, должны подчиняться каким-то “грамматическим” правилам. По-видимому, существуют и правила “орфографии”, определяемые закономерностями формирования вторичной и третичной структуры нуклеиновых кислот, а также соотношением структуры молекул с их информационными свойствами. Изучение подобных правил может стать основной задачей структуральной лингвистики /7/.
В эукариотических геномах содержится до 50 % сателлитной ДНК, состоящей из блоков тандемно повторяющихся нуклеотидных последовательностей. Различают микросателлитную (до 4 п.о. в повторе) и минисателлитную (более 4 п.о.) ДНК. Блоки комплементарных нуклеотидных повторов могут взаимодействовать между собой и участвовать в межмолекулярных взаимодействиях, необходимых для биопроцессорной обработки информации, и/или в регуляции экспрессии генов /8/.
К другому типу повторов относятся последовательности, подразделяемые на SINE (короткие) и LINE (длинные) диспергированные элементы. Длина SINE-элементов находится в пределах 400 п.о., а у LINE- элементов достигает 7 000 п.о. В геноме человека содержится около 1 млн. Alu-повторов, относящихся к SINE-элементам, и более 100 тысяч длинных MaLR-повторов /1/.
Общими чертами диспергированных элементов являются их транскрибируемость и способность к транспозиции. Эти особенности могут определяться участием таких нуклеиновых кислот в работе ядерного биопроцессора. Транскрибируемость, например, может быть связана с необходимостью перевода двунитевой ДНК в однонитевую РНК, способную к межмолекулярным взаимодействиям. Транспозиция способна перемещать диспергированные элементы и изменять их взаиморасположение, приводя к функциональной адаптации структуры биопроцессорной ДНК.
Наиболее загадочной особенностью структуры эукариотических генов является их мозаичная интрон-экзонная структура. Гены без интронных вставок являются у эукариот довольно редким исключением. Экзоны, как правило, кодируют транслируемые последовательности, а вот назначение интронов совершенно непонятно. Наиболее привлекательная гипотеза объясняет мозаичность генов существованием сложной системы регуляции их экспрессии на уровне сплайсинга, причём в подобной регуляции принимает участие взаимодействие интронов с ещё не изученными регуляторными последовательностями /9/.
Средняя длина экзонов составляет 137 п.о., тогда как длина интронов может превышать 100 000 п.о. /1/. Считается, что в результате сплайсинга интроны удаляются из мРНК, но в большинстве случаев правильнее рассматривать этот процесс как контролируемое удаление экзонов из мозаичной молекулы, основная часть которой представлена интронами.
После сплайсинга мРНК переходит в цитоплазму, а многочисленные петлевидные молекулы интронной РНК остаются в ядре. Подобные молекулы способны нести информацию о количестве и характере РНК, поступившей в цитоплазму, и/или непосредственно регулировать созревание пре-мРНК через сложную сеть специфических межмолекулярных взаимодействий. Нельзя исключить и вероятность существования глобальной мультимолекулярной многофункциональной биопроцессорной сети, в которой интроны функционируют в качестве регуляторов экспрессии генов, причём подобная регуляция осуществляется как через сплайсинг, так и через многочисленные энхансеры (усилители) и сайленсеры (ингибиторы) транскрипции.
Синтезируемая в ядре РНК объединяется в гетерогенные ядерные рибонуклеопротеиновые комплексы (гяРНП), ассоциированные с компонентами аппарата сплайсинга и ядерным матриксом. Для комплексов гяРНП характерно диффузное распределение в цитоплазме, но часть из них может концентрироваться в окрестностях спеклов (см. далее) и даже перемещаться в цитоплазму и снова возвращаться в ядро.
Некоторые факты указывают на то, что перемещение РНК от гена к ядерной мембране не является следствием простой диффузии. Да и расположение генов, в соответствии с моделью ядерной фиксации (gene gating model), может быть функционально связано с определёнными участками (и порами) ядерной мембраны /1/.
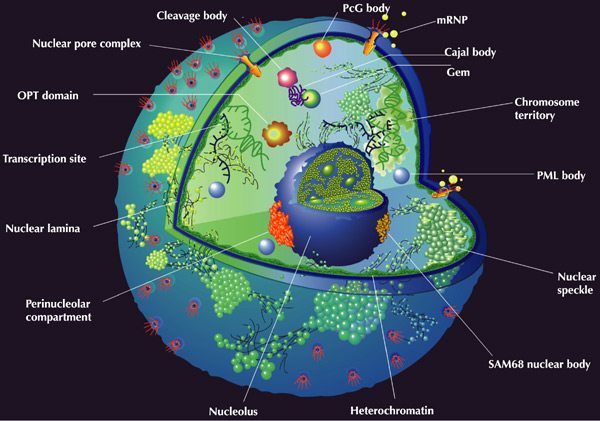
Архитектоника ядра
Ядро окружено сложной оболочкой, к внутренней стороне которой прилегает электронно-плотный слой ядерной ламины. Пронизанная белковым скэффолдом (скелетом или ядерным матриксом) нуклеоплазма содержит хроматин — упорядоченные структуры, содержащие ДНК, а также гистоны и негистоновые белки.
В зависимости от степени компактизации ДНК различают эухроматин, в котором экспрессируется основная часть генов, и гетерохроматин, обладающий пониженной транскрипционной активностью. Гетерохроматин, в свою очередь, подразделяется на конститутивный, который часто состоит из повторяющихся последовательностей ДНК, и факультативный, формирующийся на определённых стадиях жизненного цикла организма и обычно присутствующий лишь в одной хромосоме из пары гомологов. Структурно отличающиеся участки хроматина могут быть фланкированы инсуляторами – пограничными последовательностями нуклеотидов, принимающими участие в активации транскрипции генов.
У эукариот выделяют три уровня структурной организации хроматина: 1) нуклеосомная фибрилла; 2) соленоид (нуклеомер); 3) петельно-доменная структура, включающая хромомеры /1/. Хромомеры формируются в результате специфического взаимодействия ядерного матрикса с MAR/SAR-последовательностями ДНК (Matrix Associated Region / Scaffold Associated Region) /8/. Топологические домены, выделяемые MAR/SAR-последовательностями, могут изменяться в процессе индивидуального развития организма, что сопровождается изменением характера экспрессии больших блоков генов в дифференцирующихся клетках. Кроме того, эти последовательности участвуют в формировании оси хроматиды, образующей вместе с петлями хроматина тело метафазной хромосомы /1/.
Распределение участков гетеро- и эухроматина в интерфазных хромосомах упорядочено и, по-видимому, может служить видовым признаком. Теломерные участки хромосом находятся вблизи оболочки, тогда как активно экспрессирующиеся гены локализуются преимущественно во внутренних частях интерфазных ядер. Показано, что отдельные хромосомы в ядре не смешиваются и занимают дискретные зоны, на периферии которых находятся компоненты аппарата сплайсинга и треки синтезируемой РНК /1/.
Наиболее крупным нехромосомным компартментом ядра является ядрышко – нуклеопротеиновый комплекс, в котором различают три основные высокоупорядоченные зоны: фибриллярный центр, окружающую его фибриллярную зону и внешнюю гранулярную область. Считается, что наблюдаемые изменения структуры ядрышка определяются его функцией внутриядерного микрокомпартмента биогенеза рибосом. В последнее время появились данные, указывающие на участие ядрышка в регуляции клеточного цикла /1/.
Морфологически в нуклеоплазме различают клубки переплетённых нитей, которые часто ассоциированы с периферией ядрышка (свёрнутые тельца), плотные фибриллярные кольца (ядерные тельца PML), ядерные домены WT1 и тельца Барра (компактный гетерохроматин неактивной X-хромосомы). На границах доменов конденсированного хроматина располагаются перихроматиновые фибриллы — рибонуклеопротеиновые комплексы диаметром 3…20 нм. Здесь же обнаруживают компоненты аппарата сплайсинга, удаляющего интроны из предшественников мРНК. Кроме того, синтез РНК тесно ассоциирован с дискретными межхроматиновыми гранулами, называемыми спеклами, причём каждое ядро содержит от 20 до 50 спеклов /1/.
К сожалению, изучение ядерной архитектоники сопряжено с большими методическими трудностями, но накопленной информации вполне достаточно, чтобы констатировать чрезвычайно высокую сложность структурной организации клеточного ядра. Это не может служить доказательством существования ядерных биопроцессоров, в которых информационные потоки обрабатываются молекулярными логическими элементами, но позволяет не отвергать подобную возможность a priori.
Разумная изменчивость
Если в процессе эволюции возникла молекулярная система, обладающая элементами сознания, то её главной задачей должно было стать самосовершенствование. Это могло привести к появлению механизмов редактирования нуклеотидных последовательностей, изменяющих кодирующий потенциал мРНК или целенаправленно воздействующих на основания геномной ДНК.
В последние годы обнаружено несколько механизмов редактирования РНК на посттранскрипционном уровне. Показано, например, что у митохондрий слизневиков во множественные участки РНК встраиваются остатки цитозина. В митохондриях трипаносом в редактировании РНК, вероятно, принимают участие сложные нуклеопротеидные комплексы – эдитосомы /1/.
В митохондриальных и ядерных транскриптах позвоночных животных при полиаденилировании мРНК появляются бессмысленные кодоны, приводящие к преждевременной терминации трансляции и к синтезу новых полипептидных цепей. В митохондриях высших растений в результате ферментативного дезаминирования некоторые остатки C заменяются на U. Подобный механизм редактирования мРНК обнаружен и в хлоропластах /1/.
Изучение посттранскрипционного редактирования мРНК ещё только начинается, но вполне вероятно, что подобный феномен, встречающийся и у прокариотических микроорганизмов, для эукариот является правилом, а не исключением. Гораздо более проблематичным является вопрос о наличии у эукариот молекулярных механизмов коррекции геномной ДНК, способных влиять на эволюцию животных и растений.
Существование направленной (адаптивной) генетической изменчивости отрицается современной наукой, поэтому обнаружение статистически достоверного повышения частоты появления Lac+ ревертантов кишечной палочки на среде с лактозой /9/ чуть не стало “ересью”, способной оживить старый спор неоламаркистов с неодарвинистами. Но всё благополучно завершилось появлением нескольких гипотез, объясняющих данный феномен на основании постулата о ненаправленности изменчивости, доказанного ещё в середине прошлого века при помощи экспериментов всё с той же кишечной палочкой.
Ненаправленность изменчивости, являющаяся одной из основных аксиом синтетической теории эволюции, имеет много оппонентов /12, 13/. Их возражения не противоречат доказательствам, полученным в экспериментах с прокариотами, так как основаны преимущественно на необъяснимых с позиций неодарвинизма закономерностях эволюции эукариот. К сожалению, одной только констатации подобных фактов недостаточно для доказательства разумности генетической изменчивости эукариот. Современная наука требует, чтобы подобные доказательства опирались на достижения молекулярной генетики. Для этого необходимо рассмотреть механизмы модификации ДНК, которые могут использоваться эукариотами для самосовершенствования.
Простейшим вариантом генетической адаптации является обратимая дупликация генов, характерная как для бактерий, так и для эукариот. Дупликация генов, детерминирующих синтез рибосомной РНК, контролируется на молекулярном уровне, но этот вид адаптивной изменчивости можно причислить к обычным механизмам регуляции экспрессии генов.
Более сложные адаптивные модификации генома могут быть связаны с метилированием ДНК. Содержание метилцитозина в ДНК эукариот достигает 7% /11/. Эукариотическая (цитозин-5)-ДНК-метилтрансфераза действует преимущественно на двунитевую ДНК, одна из нитей которой уже содержит метилированный динуклеотид СpG. Такая специфичность фермента обеспечивает наследуемость признаков, определяемых заменой цитозина на метилцитозин. Метилирование ДНК является одним из основных факторов тонкой регуляции экспрессии генов и, вполне вероятно, способно участвовать в эпигенетической адаптации, ускоряющей эволюцию эукариот. Косвенным указанием на участие метилирования не только в микроэволюции, но и в формировании новых видов, может оказаться до неприличия высокое сходство секвенированных генов человека и шимпанзе.
Пока нет никаких доказательств участия метилирования ДНК в адаптивной изменчивости эукариот, но участие его в эпигенетическом наследовании некоторых признаков уже не вызывает особых сомнений. Метилирование вполне может лежать в основе некоторых проявлений адаптивной эволюции эукариот. Вопрос только в том, насколько подобная адаптация управляема, т.е. способен ли геном модифицировать сам себя, причём не методом проб и ошибок, а вполне целенаправленно.
Один из уже известных механизмов целенаправленной адаптации эукариотических клеток является диминуция хроматина, т.е. запрограммированная потеря значительной части хромосомной ДНК при формировании некоторых многоклеточных организмов /14/. Рекорд по доле элиминируемого генома пока принадлежит циклопу Cyclops kolensis. В ядрах соматических клеток этого циклопа сохраняется всего лишь 6% генома стволовых клеток /15/. Менее выраженные генетические перестройки и делеции участков хромосом соматических клеток являются скорее правилом, чем исключением. Главной особенностью подобных генетических модификаций является их строгая генетическая детерминированность.
Программированные перестройки хромосом соматических клеток выпадают из поля зрения эволюционистов, так как подобные модификации генома не передаются по наследству. Но если программированные диминуции хроматина и другие хромосомные перестройки связаны с вполне осмысленными действиями ядерного биопроцессора, то нельзя исключить и возможность существования разумной генетической адаптации эукариот, определяющей высокую скорость их эволюцию.
Вместо заключения
embor.embopress.org/content/4/1/18
СПИСОК ЛИТЕРАТУРЫ
1. Патрушев Л.И. Экспрессия генов. — М.,«Наука», 2000 г. – 527 с.
2. Валиев К.А., Кокин Ф.Ф. Из итогов XX века: От кванта к квантовым компьютерам // aakokin.chat.ru/xx.htm
3. Валиев К.А. Квантовая информатика: компьютеры, связь и криптография // Вестник РАН. – 2000 г. – Т. 70, № 8. – с. 688-685.
4. Гаряев П.П., Македонский С.Н., Леонова Е.А. Биокомпьютер на генетических молекулах как реальность // Информационные технологии. – 1997 г. — № 5.
5. Лучинин В.В., Мальцев П.П. Биомолекулы как базис информационных систем будущего // Информационные технологии. – 1997 г. — № 5.
6. Гаряев П.П. Волновой генетический код. — М., 2000 г.
7. Стругацкий А.Н., Стругацкий Б.Н. Попытка к бегству // В сб.: Избранное. – М., “Московский рабочий”, 1989 г. – с. 289-379.
8. Davidson E.H., Britten R.J. Regulation of gene expression: possible role of repetitive sequvences // Sience. – 1979. – Vol.204. – P.1052-1059.
9. Глазков М.В. Петельно-доменная организация генов в эукариотических хромосомах // Молекул. биология. — 1995. — Т.29. – с. 965-982.
10. Miller J.H. Spontaneous mutators in bacteria: insight into pathways of mutagenesis and repair // Annu. Rev. Microbiol. – 1996. – Vol.50. — P.625-643.
11. Льюин Б. Гены / Пер. с англ. — М., “Мир”. – 1987. – 544 с. (с.295-296).
12. Любищев А.А. Проблемы формы систематики эволюции организмов: Сб. статей. — М., «Наука». — 1982. — 278 с.
13. Берг Л.С. Номогенез, или эволюция на основе закономерностей // В сб.: Берг Л.С. Труды по теории эволюции. – 1977. – Л., “Наука”. – С.95-311.
14. Акифьев А.П. Диминуция хроматина – феномен, предназначенный для исследования ряда ключевых вопросов генетики // Вавиловский жернал генетики и селекции. — 1998. — №6 (http://www.bionet.nsc.ru/vogis/vestnik.php?f=1998&p=6_5)
15. Гришанин А.К., Худолий Г.А., Шайхаев Г.О. и др. Генетика. 1996. Т. 32. С. 492.
Автор: genseq






