На Хабрахабре в самом начале 2013 года после объявления о старте европейского мега-проекта по изучению человеческого с бюджетом более миллиарда евро, рассчитанного на 10 лет, была опубликована соответствующая заметка. В конце же минувшего года проект был официально запущен, и выделены первые средства, но до сих пор не было написано ни единого слова о том, какой научный базис лежит в основе предстоящего титанического труда, сравнимого по значимости и масштабу с расшифровкой генома человека и пилотируемой миссией на Марс.
В конце поста Вы сможете так же задать вопросы человеку, непосредственно работающему в команде The Blue Brain Project, ответы на которые выйдут отдельным постом.
Вместо предисловия
Итак, весь мега-проект разбит на 12 подпроектов, которые, вроде бы, и реализуются отдельно – как тут скрестить high-load computing с биологией, например – но тесно связаны и переплетены между собой. Не буду утомлять долгими и нудными рассказами о каждом из проектов. Для этого существуют краткие видео-ролики на официальном Youtube-канале The Human Brain Project (HBP):
На мой взгляд, одним из базовых, фундаментальных и поэтому важнейшим субпроектом является непосредственное изучение строения нейронов, их контактов и расположения – нейронной сети – в головном
Начнём с минутки истории. Точной даты открытия нервных клеток, нейронов, как таковых, пожалуй, привести нельзя. Можно лишь с уверенностью сказать, что к концу 19 века был накоплен достаточный багаж знаний о функционировании нервной ткани, чтобы в 1906 году господа Гольджи и Рамон-и-Кахаль разделили Нобелевскую премию по медицине за работы по структуре нервной системы и классификации нервных клеток.
За последние сто лет мы поняли базовые принципы функционирования нервной ткани, научились даже на относительно примитивном уровне вмешиваться в процессы в ней протекающие (например, обезболивание или операции, затрагивающие непосредственно нервную ткань), но до сего момента большим пятном оставалось то, как конкретно
Как узнать, откуда и куда идут сигналы в нервной ткани?
Опуская подробности того, что нервные клетки бывают разные, что они по-разному связаны между собой в нервной ткани, выполняют различные функции, можно, однако, выделить общие особенности в строении нейронов:
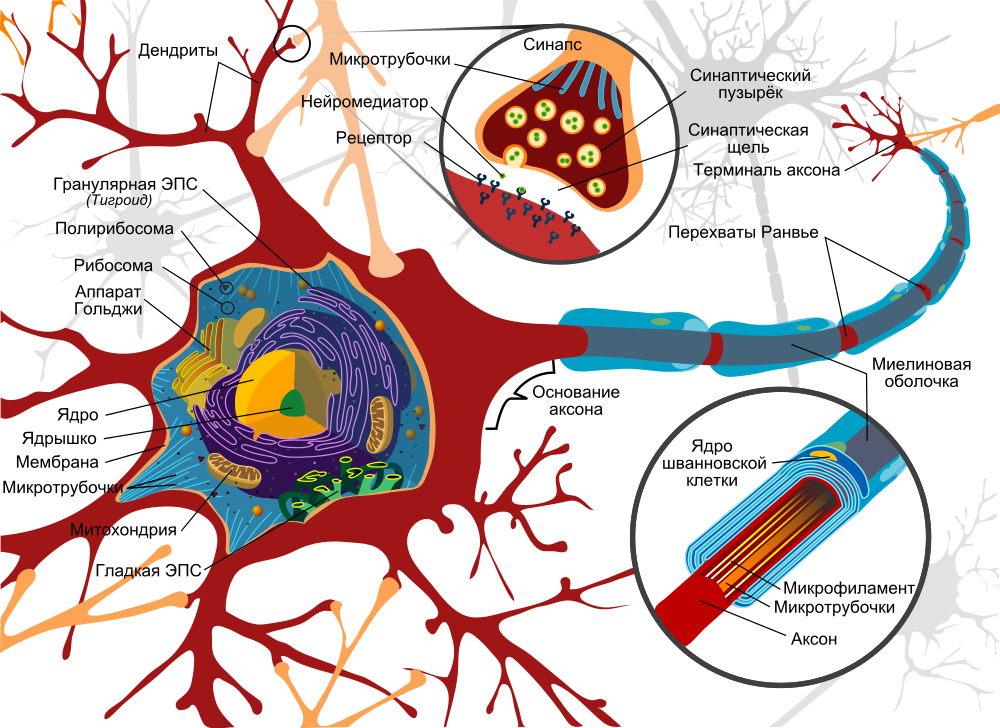
Модель нейрона. Источник
Основой передачи сигналов служат аксоны, которые как электрические кабели тянутся от одного нейрона к другому и необходимы для передачи импульсов. Теоретически они могут достигать огромной длины – до метра. Прикрепляются же аксоны к другому нейрону с помощью синапса, при этом на конце каждого аксона имеются синаптические пузырьки с нейромедиаторами:
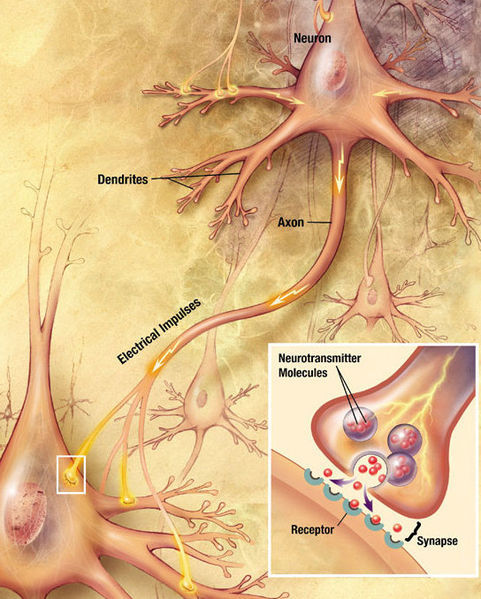
Передача импульсов между двумя нейронами. Источник
Таким образом, перво-наперво нас интересует две вещи: сам аксон и место крепления аксона к следующей нервной клетке, которое может быть определено по синаптическим пузырькам с нейромедиаторами. Для этого нам доступны только два метода, по большому счёту: флуоресцентная оптическая микроскопия и электронная микроскопия.
Предвидя логичный вопрос, а почему я не рассматриваю МРТ (магнитно-резонансную томографию) и функциональную МРТ, то эти методы используются больше для того, чтобы локализовать области, ответственные за те или иные функции (слух, зрение и прочее), но не увидеть отдельные нейроны и их сети.
Далее я буду вести речь о первом субпроекте – изучении
Но вернёмся. В первом случае – случае флуоресцентной микроскопии – необходимо покрасить нейроны с помощью флуоресцентного красителя, а затем получить снимок образца при возбуждении красителя светом определённой длины волны (часто УФ), однако разрешение данного метода позволит увидеть лишь сами аксоны, например, или только дендриты, так как они будут окрашены в разные цвета, но в целом мы с большим трудом сможем определить, как взаимодействуют нейроны.
Несколько примеров:

Новая веха — флуоресцентная 3D-микроскопия. Подробнее на русском
Видео на английском о том, как работает флуоресцентная микроскопия в случае с нервными клетками, можно посмотреть тут. К сожалению, нет встраиваемого плеера, поэтому переходите по ссылке, пожалуйста…
Другой метод – это электронная микроскопия, разрешение которой составляет единицы нанометров в случае сканирующей и доли нанометра в случае просвечивающей. Однако эти методы годятся либо для анализа поверхности (сканирующая) или тонких образцов – до 100 нм (просвечивающая). Кажется, что мы попали в тупик, не так ли?!
Загвоздка усугубляется ещё и тем, что вся ткань (мозговая или какая-либо другая) по большей части состоит из трёх основных элементов: углерода, азота и кислорода, то есть лёгких элементов. Контраста между лёгкими элементами – да ещё и перемешанными и равномерно распределёнными – не даст даже самый продвинутый в мире электронный микроскоп. Это физически не возможно.
Долго ли, коротко ли… но учёные нашли выход из этой западни. Какую информацию мы хотим извлечь? Фактически нам необходимо знать расположение мембран клеток внутри ткани, а дальше мы могли бы «восстановить» расположение самих клеток и их «внутренностей». И выход был найден в использовании солей тяжёлых металлов для «подкрашивания» мембран. Например, оказалось, что соединение осмия – OsO4 – очень хорошо осаждается на мембранах клеток или, как это принято называть, концентрируется.
Собственно, дело за малым – визуализировать. Долгое время использовалась только просвечивающая электронная микроскопия, требующая очень тонких образцов, что подвигло инженеров на разработку ультра-крио-микротома, способного отрезать от ткани слой до 30-50 нм. Просвечивающая микроскопия позволяла многим поколениям учёных изучать срезы
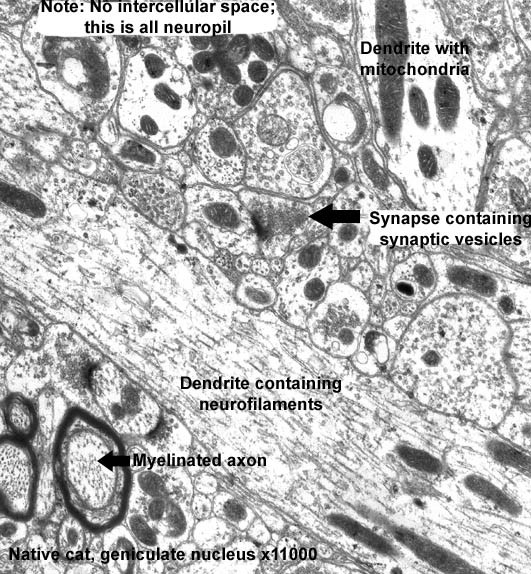
TEM-микрофотография нейропиля – скопление отростков нервных клеток (увеличение 11 000 крат). Источник
3D микроскопия: новые возможности
Хорошо. Тем или иным способом мы смогли в этом хаосе нервных клеток (а это действительно хаос, ведь по мимо самих нейронов в ткани множество вспомогательных клеток) опознать точки сочленения отдельных нейронов, однако с точки зрения построения нейронных сетей, это фактически бесполезная информация, так как нет возможности увидеть расположение клеток в трёхмерном пространстве, то есть информация о трёхмерной организации скрыта от нас. И тут был найден, я бы сказал, уникальный метод – трёхмерная микроскопия, которая стала возможна лишь в последние несколько лет, благодаря развитию вычислительной мощности компьютеров и обрабатывающей электроники микроскопов.
В центре электронной микроскопии EPFL был успешно применён подход совмещающий в себе полный цикл пробоподготовки мозговой ткани и её анализа с последующей 3D реконструкцией. Данное видео представляет основные этапы эксперимента:

Результаты фиксации образца и замещения воды специальной смолой (1:30 на видео): a. Срез мышиного

Принцип работы сканирующей электронной микроскопии с сфокусированным ионным пучком FIB/SEM (4:00 на видео): a-b. Схематическое расположение FIB-пучка, срезающего часть ткани и электронного пучка, дающего изображение, c-d. SEM-микрофотографии обрабатываемой ткани.
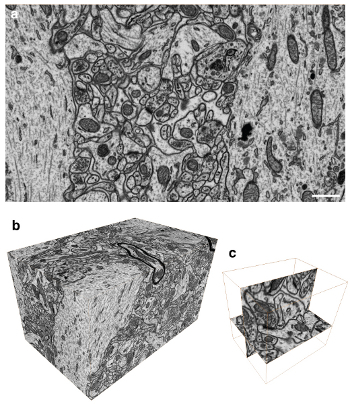
a. Визуализация с помощью FIB/SEM (5:55 на видео) и b-c. Конечный результат (8:00 на видео)
Основное достоинство метода – «срезание» всего лишь 5 нм слоя мозговой ткани сфокусированным ионным пучком (FIB) и последующее сканирование для получения изображения электронным пучком (SEM). Таким образом, мы имеем возможность предельно точно изучить строение нервной ткани, но что более важно – теперь процесс обработки таких стеков (до 2000 изображений) может быть выполнен фактически в автоматическом режиме без участия человека, благодаря использованию специальных алгоритмов анализа изображения, дающих точность реконструкции зачастую не ниже, чем профессионалы-микроскописты.
Группа Марко Кантони (Marco Cantoni) использовала free-ware программу специально разрабатываемую для подобного рода анализа – ilastik. Проект имеет своё представительство на github, поэтому, если кому-то из уважаемых читателей Хабра будет интересно поучаствовать в проекте или предложить свои новые идеи, то не думаю, что разработчики откажут.
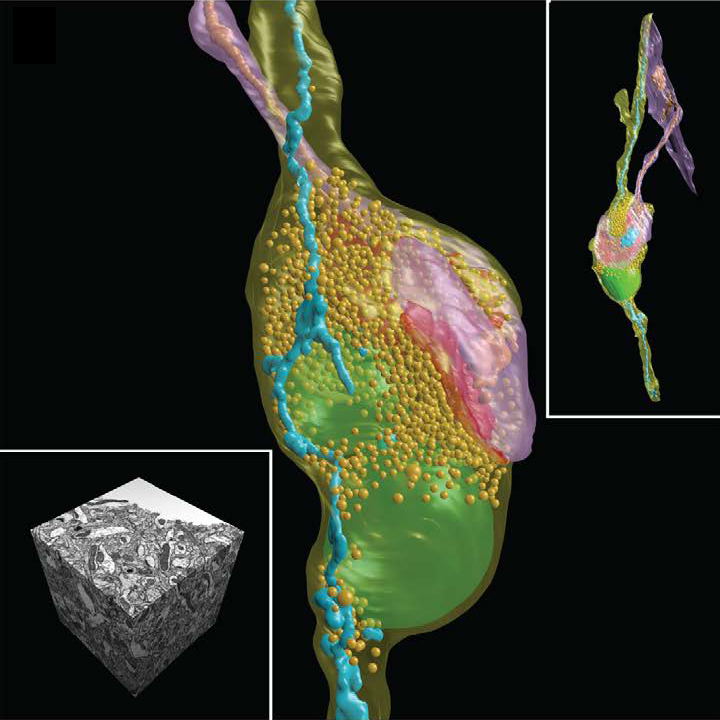
В конечном счёте, мы имеем 3D карту кусочка
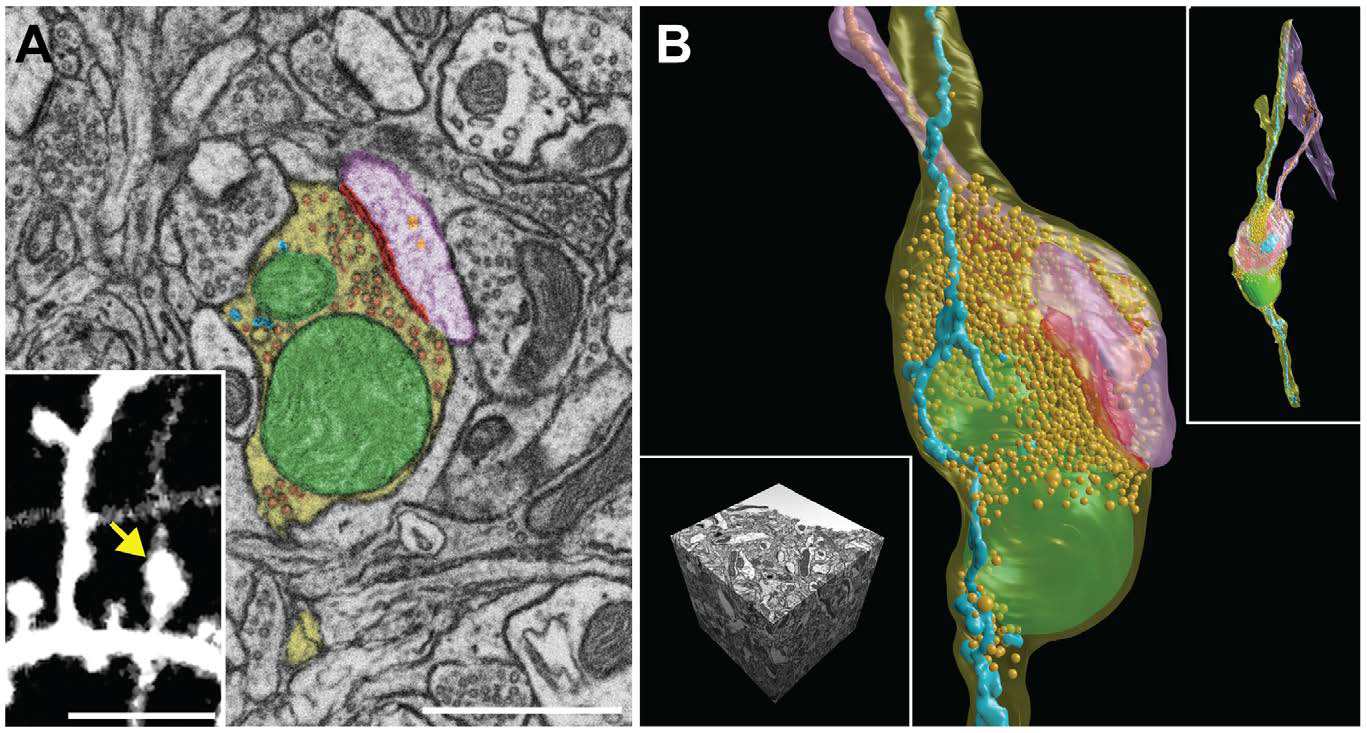
SEM-микрофотографии и 3D реконструкция синоптического контакта и всех мембран внутри нейрона головного
PS: Оглядываясь назад и понимая, какой рывок сделала электронная микроскопия за последнее десятилетие, я хотел бы отметить, что автоматизированные системы, в том числе разработанные в рамках данного проекта, позволят через 5-7 лет обрабатывать гораздо большие массивы данных, и тогда, дело останется за малым – лишь создать 3D карту нашего
При подготовки были использованы материалы открытых источников: 1, 2, 3
Автор: Tiberius






